- •382 Глава 13
- •Глава 14
- •384 Глава 14
- •386 Глава 14
- •388 Глава 14
- •390 Глава 14
- •392 Глава 14
- •Если аминокислоты: триптофан, тирозин, фенилаланин и гистидин—перемещаются в менее полярное окружение, Хмакс и є возрастают. Следовательно:
- •394 Глава 14
- •Абсорбционная спектроскопия 395
- •400 Глава 14
- •402 Глава 14
- •404 Глава 14
- •406 Глава 14
- •408 Глава 14
- •410 Глава 14
- •412 Глава 14
- •414 Глава 14
- •Глава 15
7.
В общем случае вязкость повышается
при добавлении различных солей в
воду, это означает, что г)отн>1.
Однако в нескольких случаях для
разбавленных растворов г|0тн^1.
Предложите возможное объяснение.
8.
При некоторых значениях ионной силы
и pH индивидуальный полинуклеотид
обладает достаточно малой зависимостью
т|уд/с от с и [г\] почти не зависит
от сдвига. При изменениях pH зависимость
от концентрации и от сдвига заметно
повышается так же, как истинное значение
[г)1. Каково возможное действие
изменения pH?
9.
Обычно в растворах нативной ДНК из-за
жесткости молекулы наблюдается
относительно небольшая зависимость
[ті] от ионной силы.
Однако отдельные препараты ДНК,
выделенные из бактерий, обладают таким
свойством, что при низкой ионной силе
[т]] становится существенно меньше.
Более того, если раствор разбавить
прежде, чем понизить ионную силу, Т|0тп
оказывается выше, чем в том случае,
если ионную силу понизили перед
разбавлением раствора. Это не
соблюдается для всех препаратов ДНК
из этой бактерии. Какое возможное
объяснение такого эффекта для данного
образца?
10.
Препарат суперепирализованной ДНК
подвергли обработке, при
которой
с постоянной скоростью через каждые
30 мин происходит один одноцепочечный
разрыв. В среднем требуется 10 таких
одноцепочечных разрывов прежде, чем
произойдет разрыв двойной спирали.
Предположим, что измерения можно
производить достаточно быстро, так
что вязкость существенно не изменится
за время измерения. Нарисуйте график
зависимости Т)отн ОТ времени.382 Глава 13
\ЧАСТЬ
СПЕКТРОСКОПИЧЕСКИЕ
МЕТОДЫ
Абсорбционная
спектроскопия
Молекулы
поглощают свет. Длины волн, при которых
происходит поглощение, и степень
поглощения зависят от структуры и от
окружения молекулы, поэтому абсорбционная
спектроскопия является полезным
инструментом для характеристики
макромолекул различного размера.
Общая
теория поглощения света молекулами
Световая
волна состоит из взаимно перпендикулярных
электрического и магнитного полей,
амплитуды которых по мере распространения
в пространстве изменяются по синусоиде
(рис. 14-1).
Энергия
волны Е
равна
где
h
— постоянная Планка, с
— скорость света, λ — длина волны,
v — частота. Когда волна
сталкивается с молекулой, она может
либо рассеиваться
(т. е. изменяется направление ее
распространения), либо поглощаться
(т. е. ее энергия передается молекуле).
Относительная вероятность протекания
того или иного процесса является
свойством той молекулы, с которой
произошло столкновение. Если произошло
поглощение электромагнитной энергии
света, о молекуле говорят, что она
возбуждена
или перешла в возбужденное
состояние.
Молекула или часть молекулы, которая
может быть возбуждена посредством
поглощения света в видимой и ближней
УФ-области, называется хромофо-
(1)Глава 14
![]()
РИС.
14-1.
Распространение
электромагнитной волны в пространстве.
Векторы Е и Н все время взаимно
перпендикулярны.
ром.
Обычно энергия возбуждения превращается
в тепло (кинетическую энергию) в
результате столкновения возбужденной
молекулы с другой молекулой (например,
молекулой растворителя). В случае
некоторых молекул она вновь излучается
(в гл. 15 детально обсуждается механизм
флуоресценции). В обоих случаях
интенсивность света, прошедшего через
молекулу, содержащую набор хромофоров,
меньше интенсивности падающего
света.
Возбужденная
молекула обладает набором дискретных
квантованных энергетических
состояний, описываемых законами
квантовой механики. Эти состояния
называются энергетическими
уровнями
молекулы. Главные энергетические уровни
определяются возможным пространственным
распределением электронов и называются
электронными
энергетическими уровнями;
на них накладываются колебательные
уровни,
которые указывают на различные типы
колебаний молекулы [например, растягивание
и изменение углов различных ковалентных
связей]. Имеются и еще более близко
расположенные уровни, называемые
вращательными,
но они не очень важны в абсорбционной
спектроскопии и не будут обсуждаться.
Все эти энергетические уровни обычно
описываются схемой
энергетических уровней
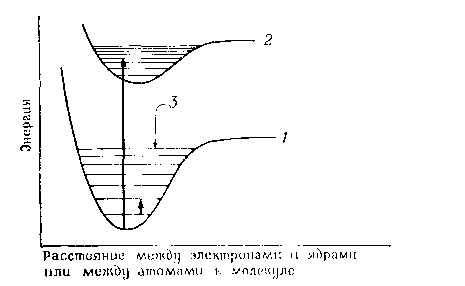
(рис. 14-2). Самый низкий электронный
уровень называется основным
состоянием, а
все другие — возбужденными.
Поглощение
энергии происходит с наибольшей
вероятностью только в том случае, если
количество поглощенной энергии
соответствует разности энергий
квантованных состояний. Это можно
выразить, констатируя, что свет с длиной
волны λ поглощается только тогда, когда
(2)384 Глава 14
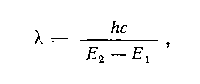
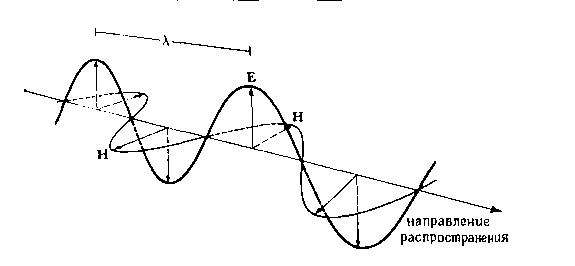
РИС.
14-2.
Типичная
схема энергетических уровней, показывающая
основное состояние (Ї)
и первое возбужденное состояние
(2).
Тонкими горизонтальными линиями
показаны колебательные уровни (3).
Длинная
стрелка указывает на возможный
электронный переход между основным
состоянием и четвертым колебательным
уровнем первого возбужденного состояния.
Короткая стрелка означает переход
с одного колебательного уровня на
другой в пределах основного состояния.
где
Е1
— энергетический уровень молекулы до
поглощения, а Е2
— энергетический уровень, достигаемый
в результате поглощения.
Изменение
энергетического состояния при испускании
или поглощении кванта называется
переходом.
Упрощенно переход между электронными
энергетическими уровнями соответствует
энергии, необходимой для перемещения
электрона с одной орбитали на другую.
На схеме энергетических уровней
переходы изображаются вертикальными
стрелками. Зависимость вероятности
поглощения от длины волны называется
спектром
поглощения.
Задача абсорбционной спектроскопии
состоит в накоплении и анализе данных
по поглощению. Если бы все переходы
происходили только между самыми низкими
колебательными уровнями основного
состояния и первого возбужденного
состояния, тогда спектр поглощения
состоял бы из узких, дискретных линий.
Однако, поскольку возможны переходы с
основного состояния на любой
колебательный и вращательный уровни
первого возбужденного состояния, а
линии имеют конечную ширину, то спектр
проявляется в виде относительно плавной
кривой (рис. 14-6). Для большинства молекул
длины волн, соответствующие переходам
между основным состоянием и любым
колеба-
Далеко
не все переходы происходят с высокой
вероятностью; в реальных системах
действуют определенные ограничения,
или правила
отбора квантовой
механики. Эти правила не будут здесь
обсуждаться.
13—383
АБСОРБЦИОННАЯ
СПЕКТРОСКОПИЯ 385