
- •Цели и задачи дисциплины. Ее место в учебном процессе Цель преподавания дисциплины
- •Задачи изучения дисциплины
- •Техническая термодинамика
- •Основные понятия термодинамики Термодинамическая система
- •Термодинамический процесс
- •Теплота и работа
- •Уравнение состояния
- •Теплоемкость
- •Внутренняя энергия
- •I закон термодинамики
- •Аналитическое выражение I закона термодинамики
- •Формулировка I закона термодинамики
- •Вычисление изменения внутренней энергии
- •Энтальпия
- •Энтропия
- •Анализ основных термодинамических процессов с идеальными газами
- •Изохорные процесс
- •Изобарный процесс
- •Изотермический процесс
- •Адиабатный процесс
- •Политропные процессы
- •Второй закон термодинамики
- •Цикл Карно
- •Для цикла Карно
- •Обратный Цикл Карно
- •Водяной пар
- •Диаграмма p,V водяного пара
- •Определение параметров воды и пар
- •Параметры состояния влажного насыщенного пара
- •Основные процессы изменения состояния водяного пара
- •Циклы паросиловых установок
Изобарный процесс
Изобарным процессом называется процесс, протекающий при постоянном давлении.
1) р = const.
2 )
)
P
T
2



dS > 0
δq > 0
1
2
1


l
qp
V
S



Рис. 10
3) pV1 = RT1; pV2 = RT2.
Разделив почленно эти выражения, получим:
![]() ;
;
![]() ;
;
![]() .
.
4) Изменение внутренней энергии и энтальпии
ΔU = U2 – U1 = Cv (T2 – T1);
Δi = i2 – i1 = Cp (T2 – T1).
5) Изменение энтропии и графическое изображение процесса в системе T, S координат, рис. 10
![]() .
.
6) Работа изменения объема
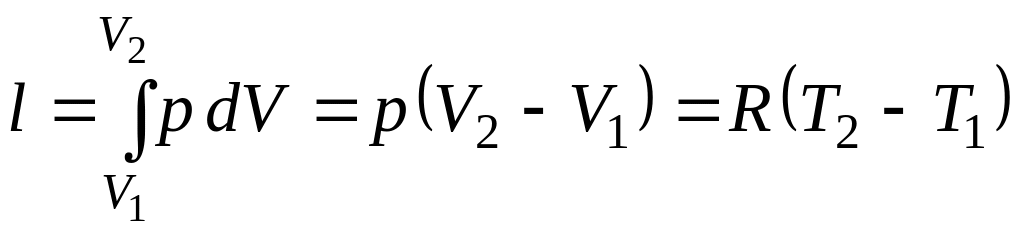 .
.
7) Теплота процесса
δq = Cpm dT; q = Cpm (T2 – T1).
8) Аналитическое выражение I-го закона термодинамики.
Все подведенное к рабочему телу тепло расходуется на изменение внутренней энергии и работу изменения объема
δq = dU + δl; q = ΔU + l.
Из рассмотрения выражения I закона термодинамики получим:
q = ΔU + l
или
Cp (T2 – T1) = Cv (T2 – T1) + R (T2 – T1)
откуда
Cp = Cv + R; Cp – Cv = R.
Приведенное выражение называют уравнением Майера. Поясним уравнение Майера.
В изохорном процессе, согласно I закону термодинамики, тепло, подведенное к рабочему тела, расходуется только на изменение внутренней энергии, а в изобарном – на изменение внутренней энергии и работу, поэтому изобарная теплоемкость больше изохорной на величину работы. Напомним, что газовая постоянная представляет собой работу 1 кг рабочего тела в изобарном процессе при изменении температуры на 1 К
Изотермический процесс
Изотермическим процессом называется процесс, протекающий при постоянной температуре.
1) Т = const.
2)
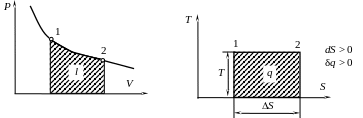
Рис. 11
В системе p, V координат изотерма представляет собой равнобокую гиперболу.
3) Из соотношения p1V1
= p2V2
= const получим:
![]() .
.
4) Изменение внутренней энергии и энтальпии
dU = Cvm dT = 0; ΔU = U2 – U1= 0
di = Cpm dT = 0; Δi = i2 – i1 = 0.
Изменение внутренней энергии (идеального газа) не происходит
5) Изменение энтропии и изображение процесса в системе T, S координат, рис. 11.
![]() .
.
6) Работа изменения объема
 .
.
Подставим в подинтегральное
выражение значение
![]()
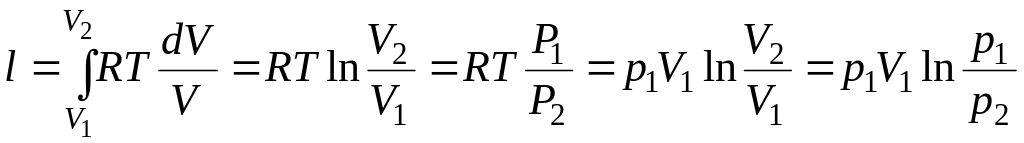 .
.
7) Теплота процесса:
![]() .
.
8) Аналитическое выражение I закона термодинамики.
Всё подведенное к рабочему телу тепло расходуется на работу изменения объема. δq = δl; q = l.
Адиабатный процесс
Процесс, протекающий без теплообмена с окружающей средой, называется адиабатным. В адиабатном процессе δq = 0; q = 0.
Получим уравнение адиабаты
Первый закон термодинамики
dU + δl = 0
Cv dT + p dV = 0. (13)
Продифференцируем характеристическое уравнение состояния
pdV + Vdp
= RdT, откуда dT
=
![]() (pdV
+ Vdp).
(pdV
+ Vdp).
Подставим значение dT в уравнение (13)
![]() (pdV
+ Vdp) + pdV = 0.
(pdV
+ Vdp) + pdV = 0.
Преобразуем приведенное выражение
![]() ;
;
![]() .
.
![]() ;
;
![]() .
.
Разделив переменные и проинтегрировав (14), получим:
![]() ;
;
![]() ;
;
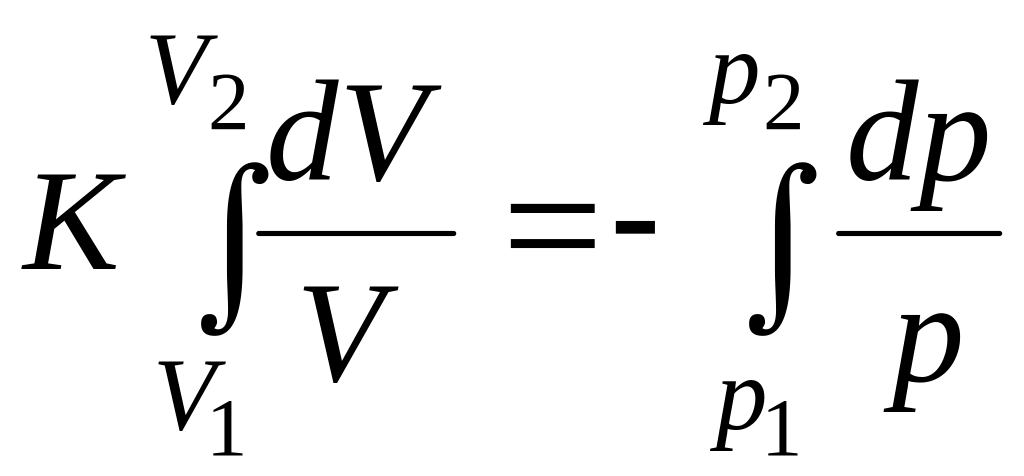 .
.
![]() ;
откуда
;
откуда
 или
или
![]() .
.
![]() . (15)
. (15)
2 )
)
Рис. 12
3) Зависимость между параметрами состояния рабочего тела
 ;
;
 .
.
![]() ;
;
![]() .
.
 ;
;
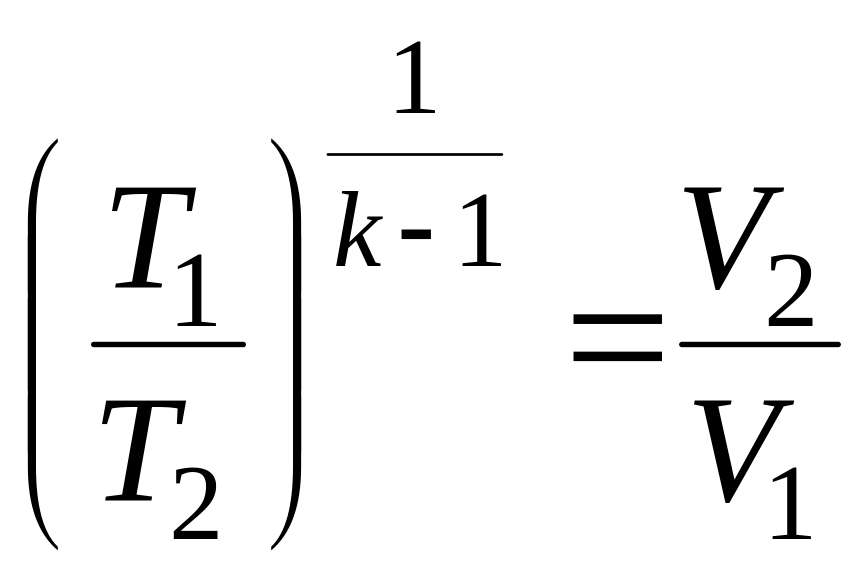 ;
;
 ;
;
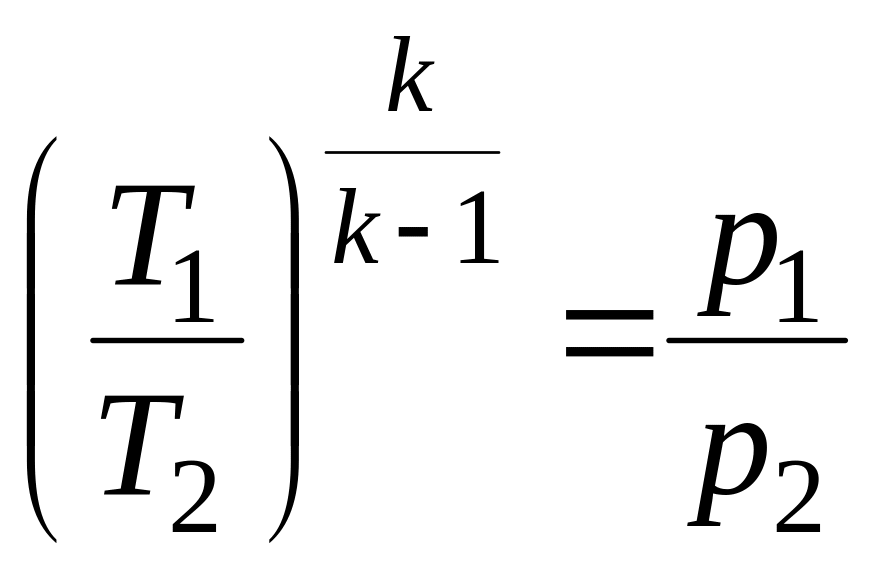 .
.
4) Вычисление изменения внутренней энергии и энтальпии
ΔU = U2 – U1 = Cvm (T2 – T1).
Δi = i2 – i1 = Cpm (T2 – T1).
5) Изменение энтропии и изображение процесса в T-S координатах:
dS =
![]() ;
δq = 0; dS = 0; ΔS = S2
– S1 = 0.
;
δq = 0; dS = 0; ΔS = S2
– S1 = 0.
В адиабатном обратимом процессе изменение энтропии не происходит. Поэтому адиабатный процесс называют изотропным.
6) Работа изменения объема
l =
![]() .
.
7) Теплота процесса
δq = 0; q = 0.
8) Аналитическое выражение I закона термодинамики. Работа совершается за счет изменения внутренней энергии
l = –ΔU = U1 – U2.
