
- •Цели и задачи дисциплины. Ее место в учебном процессе Цель преподавания дисциплины
- •Задачи изучения дисциплины
- •Техническая термодинамика
- •Основные понятия термодинамики Термодинамическая система
- •Термодинамический процесс
- •Теплота и работа
- •Уравнение состояния
- •Теплоемкость
- •Внутренняя энергия
- •I закон термодинамики
- •Аналитическое выражение I закона термодинамики
- •Формулировка I закона термодинамики
- •Вычисление изменения внутренней энергии
- •Энтальпия
- •Энтропия
- •Анализ основных термодинамических процессов с идеальными газами
- •Изохорные процесс
- •Изобарный процесс
- •Изотермический процесс
- •Адиабатный процесс
- •Политропные процессы
- •Второй закон термодинамики
- •Цикл Карно
- •Для цикла Карно
- •Обратный Цикл Карно
- •Водяной пар
- •Диаграмма p,V водяного пара
- •Определение параметров воды и пар
- •Параметры состояния влажного насыщенного пара
- •Основные процессы изменения состояния водяного пара
- •Циклы паросиловых установок
Водяной пар
В качестве рабочего тела в технике очень широко используются пары различных жидкостей. С качественной точки зрения поведение паров различных жидкостей одинаково. Рассмотрим свойства водяного пара, используемого во многих технологических процессах. Между газообразным и парообразным состоянием вещества нет резко выраженной границы
Газ можно рассматривать как высоко перегретый пар, а пар – как газ, находящийся вблизи области насыщения.
Процесс парообразования по способу получения пара можно разделись на испарение и кипение.
Испарение – это процесс получения пара со свободной поверхности жидкости. Интенсивность этого процесса зависит от природы жидкости, ее температуры, скорости движения газовой среды у поверхности жидкости и др. факторов.
В технике этот процесс играет второстепенную роль и в дальнейшем рассматриваться не будет.
Кипение – это процесс получения, пара из жидкости, наступающий при определенной температуре, зависящий от давления при подводе к жидкости теплоты.
Получение шара, для технических нужд осуществляется в паровых котлах в процессе, протекающем при постоянном давлении (изобарном) Рассмотрим процесс получения пара.
Диаграмма p,V водяного пара
Поместим в цилиндр с поршнем, нагруженным произвольной силой 1 кг воды при температуре 0 С и будем подводить к нему теплоту (рис. 25).
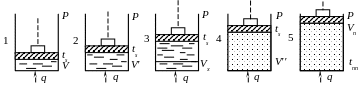
Рис. 25
Пусть в состоянии I вода находился под давлением p, температура t = 0 С, удельный объем V0.
При нагревании воды объем ее увеличивается при том же давлении до величины V', а температура достигнет температуры кипения (насыщения) ts состояние 2.
При дальнейшем подводе теплоты часть кипящей воды превратился в пар. Таким образом, в цилиндре находится смесь пара и кипящей жидкости. Пар в смеси с кипящей жидкостью называется влажным насыщенным, т.е. это пар, находящийся в динамическом равновесии с жидкостью. Характеризуется такое состояние параметрами p, Vx, ts – состояние 3.
Дальнейший подвод теплоты, приводит к полному испарению. Наступает момент, когда вся жидкость переходит в пар. Такое состояние называет сухим насыщенным паром и характеризуют параметрами p, V'', ts – состояние 4.
При дальнейшем подводе к насыщенному пару теплоты, температура его повышается и он становится перегретым – с параметрами p, Vпл, tпл – состояние 5.
Перегретым паром будем называть пар, у которого температура при заданном давлении выше температуры насыщения.
Таким образом, процесс получения пара из жидкости можно разделить на 3 стадии: I – нагрев води до температуры кипения, II – получение пара (процесс кипения) и III – процесс перегрева пара. Эти стадии протекают при постоянном давлении и изображаются изобарой. Построим изобару в системе p, V – координат нанесем на нее характерные состояния: жидкости при t0 = 0 С (точка a), начала кипения (точка b), влажного насыщенного пара (точка c), сухого насыщенного пара (точка d) перегретого пара (точка e).
|
Рис. 26 |
Если
рассмотреть процесс парообразования
при других, но постоянных давлениях
(p3 > p2 > p1 > p),
можно заметить, что точки b,
b',
b''
определяющее состояние начала кипения
с повышением давления смещаются вправо.
Это обстоятельство объясняется
увеличением – удельного объема V'
вследствие повышения температуры
насыщения
![]() .
Точки d смещаются влево,
что объясняется уменьшением удельного
объема V''
вследствие повышения давления.
.
Точки d смещаются влево,
что объясняется уменьшением удельного
объема V''
вследствие повышения давления.
Соединим характерные точки b, b' ... и d, d' ... кривыми и назовем их пограничными кривыми. Объем жидкости V0 при температуре t0 = 0 с повышением давления изменяется незначительно, соединив точки a, a' кривой получим так называемую нулевую изотерму, которую можно считать практически вертикальной. Разность объемов сухого насыщенного пара и кипящей жидкости (V'' – V') уменьшается с увеличением давления и при некотором давлении становится равной кулю. В этой точке, различие между паром и жидкостью исчезают, такое состояние вещества называют критическим.
Критическая температура – это предельная температура, при которой возможно это существование жидкости и пара. При температуре выше критической возможно существование вещества только в виде газообразного состояния. Для воды ркр = 22,129 МПа, tкр = 374,15 с, Vкр = 0,00326 м3/кг.
Кривая
ВК – объединяет состояния начала кипения
жидкости при различных давлениях и
называется левой или нижней пограничной
кривой. Кривая КД объединяет состояния
сухого насыщенного пара при различных
давлениях и называется правой или
верхней пограничной кривой. Между
кривыми ВК и КД находится область
влажного насыщенного пара; левее кривой
ВК – область недогретой до кипения
жидкости; правее кривой КД – область
перегретого пара. Состояние в области
влажного пара определяется температурой
(или давлением и степенью сухости) V
пара, под которой будем понимать массовое
отношение сухого насыщенного пара к
массе смеси кипящей жидкости и сухого
насыщенного пара
![]() состояние вещества соответствует началу
кипения (левая пограничная кривая.),
степень сухости Х = 0.
Если вещество находится в состоянии
сухого насыщенного пара (правая
пограничная кривая) Х = 1.
Следовательно, степень сухости изменяется
в пределах 0 Х 0.
состояние вещества соответствует началу
кипения (левая пограничная кривая.),
степень сухости Х = 0.
Если вещество находится в состоянии
сухого насыщенного пара (правая
пограничная кривая) Х = 1.
Следовательно, степень сухости изменяется
в пределах 0 Х 0.

