
- •Загальні положення
- •1. Біологія та рівні організації життя
- •2. Неорганічні сполуки живих систем
- •2.1. Вода: властивості та функції
- •2.2. Іони, оксиди, кислоти і солі в живих організмах
- •3. Органічні сполуки
- •3.1. Ліпіди: їх класифікація та функції
- •3.2. Вуглеводи: їх класифікація та функції
- •3.3. Амінокислоти та білки
- •3.4. Нуклеотиди та нуклеозиди
- •4.5. Нуклеїнові кислоти: днк та рнк
- •4. Клітинний рівень організації біологічних систем
- •Основні особливості організації клітин різних груп організмів
- •4.1. Поверхневий апарат клітини
- •4.2. Цитозоль та цитоскелет
- •4.3. Немембранні органели: рибосоми, клітинний центр, органоїди руху
- •4.4. Одномембранні органели: апарат Гольджі, цитоплазматичний ретикулум, лізосоми, пероксисоми, вакуолі
- •4.5. Двомембранні органели: мітохондрії, хлоропласти
- •4.6. Ядро та генетичний матеріал клітини
- •4.7. Життєвий цикл клітин
- •5. Обмін речовин, енергії та інформації в живих системах
- •5.1. Метаболізм
- •5.2. Типи організмів за джерелом енергії та поживних речовин
- •5.3. Носії енергії в метаболічних реакціях
- •5.4. Основні процеси метаболічних реакцій
- •5.5. Енергетичний та пластичний обмін вуглеводів
- •5.6. Фотосинтез — пластичний обмін вуглеводів у фототрофних організмів
- •Світлова фаза фотосинтезу
- •Темнова фаза фотосинтезу
- •5.7. Енергетичний та пластичний обмін жирів
- •5.8. Синтез білків
- •5.9. Передача інформації між клітинами
- •6. Етапи розвитку життя на Землі
- •7. Сучасна система органічного світу
- •Сучасна система органічного світу станом на 2013 р.
- •8. Структура зоології та ботаніки
- •8.1.Система багатоклітинних тварин
- •8.2. Система наземних хребетних
- •8.3. Система вищих рослин
- •Список літератури
3.3. Амінокислоти та білки
Амінокислота (азотовмісна карбонова кислота) — це хімічна речовина, молекула якої одночасно містить аміногрупу –NH2 (в деяких випадках — іміногрупу =NH) та карбоксильну групу –СООН, вуглецевий скелет та радикал, який визначає індивідуальні властивості кожної амінокислоти. В залежності від структури радикала всі амінокислоти поділяють на полярні та неполярні.
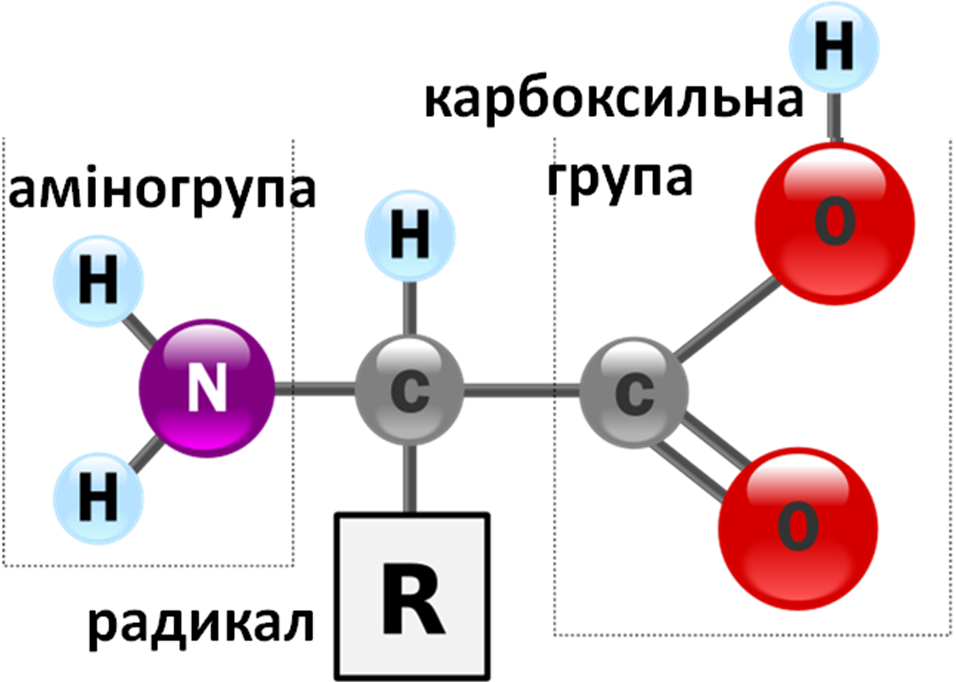
Рис. 6. Загальна структура α-амінокислот
В природі знайдено близько 100 амінокислот, однак генетичним кодом живих істот кодуються лише 20 з них, що входять до складу протеїнів (протеїногенні або стандартні). Окрім них в організмі продукуються амінокислоти, що називаються непротеїногенними або нестандартними. Вісім з 20-ти протеїногенних амінокислот називаються «незамінними» — це такі, що не виробляються в організмі та повинні надходити з їжею або синтезуватися бактеріями, що живуть у кишечнику людини. Для людини це лізин, лейцин, ізолейцин, метіонін, фенілаланін, треонін, триптофан, валін, а для дітей також гістидин та аргінін.
Функції амінокислот:
Пластична - структурні одиниці протеїнів (білків). Багато амінокислот є проміжними продуктами при синтезі інших речовин (триптофан є прекурсором нейромедіатору серотоніну, а гліцин є одним з реагентів в синтезі порфіринів, карнітин використовується для транспорту ліпідів в клітині). При заміщені амінокислотних радикалів утворюються гормони.
Регуляторна - гістамін розширює кровоносні судини, гліцин та глутамат використовуються як нейромедіатори при нервовій передачі через синапси.
Енергетична - виступають джерелом енергії при розщепленні.
Білки — складні високомолекулярні природні полімери, мономерами яких є амінокислоти, з’єднані пептидними зв'язками, що утворюється між аміногрупою однієї амінокислоти та карбоксильною групою іншої з виділенням молекули води. У звичайній еукаріотичній клітині налічується близько 10 тис. різних білків, а загальна кількість відомих білкових молекул наближається до 50 тис.
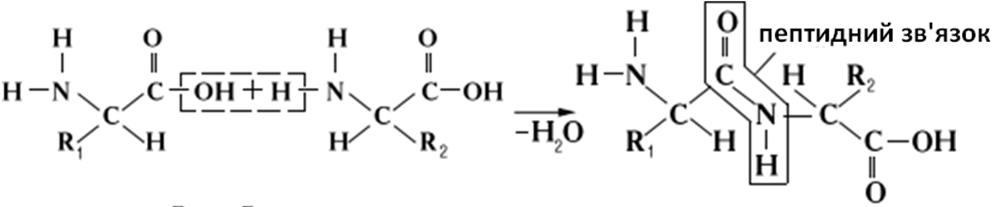
Рис. 7. Утворення пептидного зв'язку
Рівні структурної організації білків
Первинна структура —поліпептидний ланцюг амінокислот, з'єднаних між собою пептидними зв'язками. Ця послідовність закодована в молекулі ДНК і утворюється в процесі трансляції.. Білкові молекули містять від 100 до 1500 амінокислот. Якщо в поліпептидному ланцюзі менше ніж 70 амінокислот, таку молекулу називають пептидом.
Вторинна структура. Розрізняють два види вторинної структури білка — α-спіраль і β-складчастий шар (β-структура).Білкова α-спіраль стабілізується водневими зв'язками, які утворюються між атомом гідрогену групи —NН однієї амінокислоти й атомом оксигену групи —С=О іншої. Радикали амінокислот не беруть участі у формуванні водневих зв'язків і обернені назовні від спіралі. Такий тип вторинної структури мають міозин і тропоміозин — м'язові білки, які беруть участь у процесах скорочення, кератин — структурний білок волосся, нігтів, дзьоба, пір'я і рогів. Поліпептидний ланцюг у β-структурі має зигзагоподібну конфігурацію (структуру складчастого листка). Він також стабілізується водневими зв'язками. Ділянки поліпептидного ланцюга, які прилягають одна до одної, у β-структурі можуть бути як паралельними (йдуть в одному напрямі), так і антипаралельними (йдуть у протилежних напрямах). Прикладом білка, який має тільки β-складчасту вторинну структуру, є фіброїн — білок шовку, що виділяється шовковичними залозами гусениць шовкопряда під час формування коконів.
Третинна структура — тривимірна упаковка поліпептидного ланцюга, тобто укладання в просторі α-спіральних і β-структурних ділянок молекули. Третинна структура стабілізується та утримується чотирма типами зв'язків, які утворюються між радикалами амінокислот:
1) дисульфідні зв'язки між атомами сульфуру двох залишків цистеїну;
2) водневі зв'язки, що утворюються за участю атома гідрогену амінокислотних радикалів;
3) гідрофобні взаємодії між радикалами неполярних амінокислот;
4) іонні взаємодії між зарядженими групами радикалів полярних амінокислот (аспарагінової кислоти, аргініну, лізину, гистидіну).
За просторовою формою третинної структури білки поділяються на глобулярні, поліпептидні ланцюги яких згорнуті в компактні сферичні або еліпсоподібні структури (інсулін, альбумін, всі ферменти), і фібрилярні, поліпептидні ланцюги яких, розташовуючись уздовж однієї осі, утворюють довгі волокна (фібрили) або шари (колаген, еластин, міозин, фібрин).
Четвертинна структура. Деякі білки складаються не з одного, а з декількох поліпептидних ланцюгів, що кодуються різними генами (гемоглобін, велика кількість ферментів вуглеводного обміну). Таку структуру називають четвертинною, а поліпептидні ланцюги, що утворюють білок, — субодиницями. Четвертинна структура утворюється тільки після закінчення формування третинних структур окремих субодиниць і стабілізується гідрофобними й електростатичними взаємодіями.
Функції білків
Структурна. Білки утворюють основу і цитоплазми і входять до складу клітинних органел і мембран. Сухожилля, суглобові зв'язки, кістки скелета, копита складаються з білків. Наприклад, білки колаген і еластин забезпечують пружність і пластичність шкіри, судин, зв'язок.
Каталітична. Біологічні каталізатори, що прискорюють біохімічні реакції, називаються ферментами. Всі ферменти є білками. Кожний фермент каталізує одну або декілька однотипних реакцій, тому зв'язування ферменту з субстратом є високоспецифічним. Ділянка молекули білка, яка відповідає за зв'язування з субстратом, називається активним центром, а комплекс, що утворився при цьому,— фермент-субстратним комплексом. В процесі реакції фермент не піддається ні якісним, ні кількісним змінам. Ферменти мають дуже високу активність, вони здатні послідовно каталізувати тисячі й навіть мільйони реакцій за секунду. При цьому вони функціонують в дуже вузькому інтервалі умов середовища і у разі змін інактивуються.
Рухова. Будь-які форми активного руху в живій природі (робота м'язів, биття війок і джгутиків, рух хромосом під час клітинного поділу, внутрішньоклітинне переміщення цитоплазми) здійснюються скоротливими білковими структурами. Наприклад, основу поперечносмугастої мускулатури складають білки актин і міозин, які переміщаються один відносно другого, що приводить до зміни лінійних розмірів м'яза.
Транспортна. Білок еритроцитів гемоглобін транспортує кисень від легенів до тканин і органів, сироватковий білок альбумін здійснює транспорт жирних кислот. Білки клітинних мембран виконують вибіркове перенесення речовин (глюкози, амінокислот, іонів) через ліпідний бішар.
Захисна. Захист організму від дії інфекції та підтримка гомеостазу забезпечуються реакціями імунітету. Найважливішими чинниками гуморального імунітету є антитіла — білки, які маркують чужорідні біополімери — антигени. Захисну функцію також виконують білки, що безпосередньо руйнують клітини (лізоцим слини) або блокують процеси біосинтезу (інтерферон в інфікованих вірусами клітинах).
Регуляторна. Багато гормонів є білками (інсулін, глюкагон, соматотропін). Вони регулюють перебіг фізіологічних процесів — ріст клітин, інтенсивність обміну речовин.
Запасаюча - здатні накопичуватися як запасний матеріал для живлення організму, що розвивається (яєчний альбумін, білки насіння рослин).
Енергетична - розщеплюються для добування енергії у виняткових випадках, якщо в організмі в результаті тривалого голодування вичерпані запаси вуглеводів і жирів. Енергетична цінність 1 г білка складає близько 17кДж.
Рецепторна. Багато білків на поверхні плазматичної мембрани клітин здатні розпізнавати молекули певної структури. Специфічними рецепторами розпізнаються молекули гормонів і медіаторів (як правило, один рецептор може розпізнавати тільки один тип молекул). Білкові рецептори на поверхні клітин імунної системи здатні розпізнавати чужорідний антиген і запускати реакцію його знищення.
Денатурація — порушення просторової організації білкової молекули (четвертинної, третинної, вторинної структур із збереженням первинної) під впливом температури, механічного тиску, хімічних агентів; при цьому білок втрачає свої фізико-хімічні та біологічні властивості. Якщо денатуруючий агент припиняє свою дію, в деяких випадках білок набуває початкової просторової конфігурації та відновлює біологічну активність. Процес відновлення фізико-хімічних та біологічних властивостей білка називається ренатурацією. Протеоліз — порушення первинної структури білка (наприклад, під впливом ферментів шлунку або лізосом).
