
- •Модуль 1
- •Домашнее задание для подготовки к занятию
- •1.Водородные связи между атомами пептидного остова
- •2. Дисульфидные связи
- •3. Водородные связи между радикалами
- •4. Ионные связи
- •5. Гидрофобные взаимодействия
- •6. Пептидные связи
- •Примеры ситуационных задач (заданий для самостоятельной работы студентов), выполняемых на занятии.
- •Лиганды Активный центр белка
- •Занятие 3.
Модуль 1
ХИМИЯ БЕЛКОВ
Занятие 1
Тема. α-Аминокислоты. Пептиды. Белки.
Содержание темы.
-Аминокислоты. Принципы классификации, стереоизомерия, кислотно-основные свойства, изоэлектрическая точка. Пептиды, олигопептиды, белки. Уровни организации белковой молекулы. Первичная структура белка.
Новые и наиболее важные термины:
названия -аминокислот, протеиногенные и модифицированные аминокислоты, изоэлектрическая точка, пептиды, пептидная группа, пептидный остов
Разделы, выносимые на самостоятельную проработку:
Кислотно-основные свойства, стереоизомерия и классификация -аминокислот. Методы изучения первичной структуры белка.
Письменное задание для самостоятельной работы
1. Выучить формулы, названия и обозначения важнейших -аминокислот (см. схему 1).
2. Типы классификаций -аминокислот организма:
а) протеиногенные, непротеиногенные, модифицированные ;
б) по характеру боковой цепи:
- полярные (гидрофильные) и неполярные (гидрофобные);
- нейтральные, кислые и основные;
- по наличию определенных структур в радикалах (серосодержащие, ароматические, гидроксиаминокислоты, иминокислоты и др.);
в) по возможности их синтеза в организме:
- заменимые
- незаменимые (эссенциальные).
Приведите примеры на каждый тип классификации.
3.Напишите формулы серосодержащих и селеносодержащих аминокислот. Назовите их.
4.Напишите формулы гидроксиаминокислот . Назовите их. 5.Напишите формулы гетероциклических аминокислот . Назовите их.
6.Напишите формулы иминокислот (2). Назовите их.
7. Какие методы используются для изучения первичной структуры белка?
8. Биологическая роль пептидов и белков.
Домашнее задание для подготовки к занятию
Северин Е.С. Биохимия ( 2007г) - с.9-22;
Березов Т.Т., Коровкин Б.Ф. (1998г.) – с. 19-22; с.33-40; 49-60.




АК с полярными незаряженными радикалами





S
S
S
S
C
T
N
Q
Серин (Сер) Цистеин (Цис) Треонин (Тре) Аспарагин (Асн) Глутамин (Глн)
А


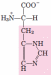


D
E
Аспарагиновая кислота (Асп)
Глутаминовая кислота (Глу)
K
H
R
Лизин (Лиз) Аргинин (Арг) Гистидин (Гис)
Рис. 1. Формулы -аминокислот (при рН=7), входящих в состав белков.
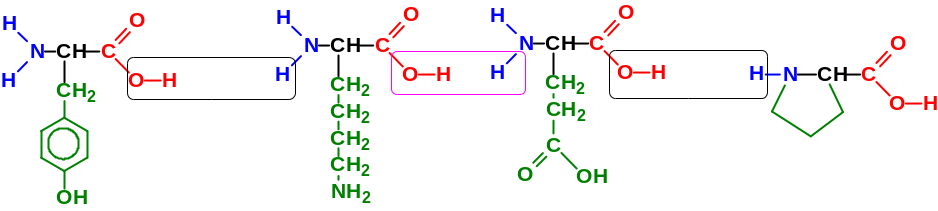

Пептидная группа





Пептидный остов
N-конец
С-конец
Пептидные связи
Рис. 2. Схема образования пептидов
Примеры ситуационных задач (заданий для самостоятельной работы студентов), выполняемых на занятии.
Укажите центры кислотности и основности в аминокислоте валине (pI=6);напишите реакции, характеризующие ее кислотно-основные свойства. Что называется изоэлектрической точкой? Нарисуйте данную аминокислоту при рН=рI (в виде диполярного иона). В какой форме существует эта аминокислота в сильнокислой среде, сильнощелочной среде и при рН=7?
Укажите центры кислотности и основности в аминокислоте лизине (pI=9,8). Нарисуйте данную аминокислоту при рН=рI (в виде диполярного иона). В какой форме существует эта аминокислота в сильнокислой среде, сильнощелочной среде и при рН=7?
Укажите центры кислотности и основности в аминокислоте Glu (pI=3,2). Нарисуйте данную аминокислоту при рН=рI (в виде диполярного иона). В какой форме существует эта аминокислота в сильнокислой среде, сильнощелочной среде и при рН=7?
Какие системы называются буферными? Покажите, какие буферные системы могут образоваться при добавлении к раствору серина а)раствора HCl б) раствора NaOH. На чем основан механизм буферного действия?
Как будет двигаться в электрическом поле аминокислота серин (рI=5,7) при рН=pI, pH<pI, pH>pI?
Смесь аминокислот, содержащая треонин, изолейцин, аспарагиновую кислоту, лизин, триптофан и серин, помещена в электрическое поле. рН среды равен 7,0. Какие из аминокислот будут перемещаться к аноду? К катоду? Останутся на месте?
Смесь аминокислот, содержащая треонин, изолейцин, аспарагиновую кислоту, лизин, триптофан и серин, помещена в электрическое поле, рН среды равен 3,5. Какие из аминокислот будут перемещаться к аноду? К катоду? Останутся на месте?
8. Напишите формулу трипептида Alа–Asp–Lys. Укажите пептидные связи, пептидные группы, N- и С-конец трипептида.
9.Напишите формулу гексапептида Asp-Ile-Pro-Cys-His-Glu . В какой среде (кислой, нейтральной или щелочной ) находится pI данного пептида?
10.В какой среде (кислой, нейтральной или щелочной) находится изоэлектрическая точка изображенного полипептида? Объясните свой ответ.
Сер-Арг-Иле-Гис-Лиз-Асп-Вал-Фен-Глу-Арг-Три-Лиз
11.Напишите гексапептид (без формул, используя сокращенные и однобуквенные обозначения аминокислот) с изоэлектрической точкой в а)щелочной среде; б)кислой среде ; в) нейтральной среде.
12.Изоэлектрическая точка белка равна 4,7. Что можно сказать о соотношении кислотных и основных групп в его молекуле? Как заряжен данный белок при рН=7?
13.Изоэлектрическая точка белка равна 8,2. Что можно сказать о соотношении кислотных и основных групп в его молекуле? Как заряжен данный белок при рН=7?
14.Изоэлектрическая точка белка равна 7,0. Что можно сказать о соотношении кислотных и основных групп в его молекуле? Как заряжен данный белок при рН=2, при рН=10?
15.Какой из полипептидов будет лучше растворяться в воде и почему:
Вал-Иле-Фен-Про-Тре или Лей-Гис-Глу-Мет-Асп?
Типовые вопросы билета контрольной работы
(проводится на 2 занятии)
1.Содержит вопросы на знание классификации аминокислот. Например:
-напишите формулы ароматических аминокислот и дайте им названия.
2.Напишите формулу Глу. Оцените, в какой области находится pI данной аминокислоты. Нарисуйте данную аминокислоту при рН=рI (в виде диполярного иона). В какой форме существует эта аминокислота в сильнокислой среде, сильнощелочной среде и при рН=7?
3.Напишите формулу гексапептида Лей-Гис-Глу-Мет-Асп.Укажите пептидные группы, пептидные связи, С,N-конец пептида. Оцените pI данного пептида и его растворимость в воде. Как будет заряжен данный пептид при рН=7 и в каком направлении двигаться в электрическом поле?
Занятие 2.
Тема. Структура белковых молекул.
Содержание темы:
Первичная, вторичная, третичная, четвертичная структура белка; этапы формирования нативной конформации белка; механизм формирования в белках активного центра и его взаимодействие с лигандом.
Белки фибриллярные и глобулярные. Белки коллагенового типа строения. Методы изучения структуры белка и методы разделения индивидуальных белков. Денатурация белков, факторы, вызывающие денатурацию; ренативация. Молекулярные шапероны. Прионы и прионовые болезни.
Новые и наиболее важные термины:
α-спираль, β-структура, фибриллярные и глобулярные белки, домены, активный центр белка, мономерные и олигомерные белки, шапероны, фолдинг , рефолдинг, денатурация белка, ренативация .
Разделы, выносимые на самостоятельную проработку:
Методы изучения структуры белка и методы разделения индивидуальных белков. Растворимость белков. Высаливание белков. Денатурация белков. ( Северин Е.С. Биохимия (2007 г.) – с. 20-23, 28-31, 67-73).
Письменное задание для самостоятельной работы
Какие свойства (2) белков определяют их растворимость? Приведите примеры растворимых и нерастворимых белков.
Перечислите факторы (4—5), вызывающие осаждение белков из растворов. Почему белки лучше всего осаждаются в изоэлектрической точке?
Что такое высаливание белков? Назовите используемые для этого вещества (2). Какие белки (альбумины или глобулины) легче высаливаются и почему?
Что понимают под денатурацией белков? Чем она вызывается? Какие свойства белков изменяются при денатурации?
Какие методы (4-5) используют для разделения смесей белков? Что лежит в основе методов электрофореза белков и ионообменной хроматографии белков? Для чего эти методы используются?
Какие методы (3) используют для очистки белков от низкомолекулярных примесей?
