
- •Закон Гесса
- •Вычисление теплового эффекта реакции при постоянном давлении. Два следствия из закона Гесса.
- •1.3 Вычисление теплового эффекта реакции при постоянном объеме.
- •1.4 Энтальпия растворения.
- •1.5 Энергия связи, энергия кристаллической решетки.
- •1.6 Количественные расчеты.
- •1.7 Зависимость теплового эффекта реакции от температуры проведения процесса. Теплоемкость.
1.7 Зависимость теплового эффекта реакции от температуры проведения процесса. Теплоемкость.
При термохимических расчетах широко используется то свойство, что
тепловой эффект химической реакции мало зависит от температуры проведения процесса.
В большинстве расчетов мы пренебрегаем зависимостью H(T). Однако для более точных расчетов эту зависимость следует учесть. Изменение теплового эффекта химической реакции в зависимости от температуры выражается законом Кирхгофа:
 ,
,
где Ср – разность сумм молярных изобарных теплоемкостей продуктов реакции и исходных веществ, взятых с учетом стехиометрических коэффициентов. Для реакции вида
аА+вВ=сС+dD
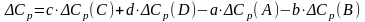 .
.
Этот закон дает возможность вычислять тепловые эффекты реакций при любых температурах, если известны зависимости теплоемкостей всех исходных веществ и продуктов реакции от температуры.
Если в температурном интервале T1-T2 происходит фазовое превращение, то интегрирование следует провести от Т1 до температуры фазового перехода, затем прибавить тепловой эффект фазового превращения при этой температуре и далее взять интеграл от температуры фазового превращения до температуры Т2.
Как на практике удобно вычислять энтальпию реакции при температуре отличной от стандартной? В справочниках обычно приводится значение молярной изобарной теплоемкости веществ при температуре 298К. (Иногда приводят и коэффициенты температурной зависимости Ср.) Обычно мы вообще пренебрегаем зависимостью энтальпии от температуры, при желании же ее учесть, мы можем воспользоваться точной, но достаточно сложной формулой Кирхгофа либо воспользоваться новым приближением. Учитывая зависимость энтальпии от температуры H(T), пренебрежем зависимостью теплоемкости от температуры Ср(T), тогда константа выносится из-под знака интегрирования, и мы получаем простую зависимость:
 ,
,
Пример 20
Определить величину H1000 для реакции получения порошка графита
4K(г)+CCl4(г)=4KCl(кр)+C(графит)
|
K(г) |
CCl4(г) |
4KCl(кр) |
C(графит) |
Hf,298 кДж/моль |
90 |
107 |
436 |
0 |
Ср,298 Дж/мольК |
|
83,4 |
51,5 |
8,5 |
Определим энтальпию реакции при стандартных условиях:
H298 =0+4(436)490(107)= 1997 кДж/моль.
Чтобы определить Ср,298 не хватает данных о теплоемкости газообразного калия. Вместо отсутствующих экспериментальных данных мы можем воспользоваться теоретическим представлением о том, что
изобарная молярная теплоемкость одноатомных газов близка к 5/2R.
Тогда Ср,298(К(г))=5/28,31 Дж/мольК=20,8 Дж/мольК.
Упомянем еще несколько полезных соотношений:
изобарная молярная теплоемкость газов, состоящих из жестких двухатомных молекул (с замороженным колебанием) близка к 7/2R.
Молярная теплоемкость металлов(кр) при обычных и высоких температурах близка к 3R.
Ср,298=8,5+451,583,4420,8=47,9 Дж/мольК
Обратите внимание, что
изобарная молярная теплоемкость простых веществ не равна нулю.
H1000 =H298 +Ср,298Т= 1997 кДж/моль+47,9 Дж/мольК(1000298)К=
= 1997 кДж/моль+33626Дж/моль= 1997 кДж/моль+33,6Дж/моль=
= 1963 кДж/моль
Хочется отметить, что полученная величина H1000 лишь на 2% отличается от H298. Для многих задач такая разница не существенна, и зависимость энтальпии от температуры можно не учитывать.
Внимание! Если Вы получили большую зависимость энтальпии от температуры, проверьте, что Вы перевели Дж в кДж.
Задачи
Вычислить H498 процесса
½H2 (г)+ ½I2(г)= HI(г),
используя следующие данные:
½H2(г) + ½I2(к)= HI(г) H298 = +24,7 кДж/моль
I2(к)=I2(г) H298 = +62,3 кДж/моль;
средние значения молярных теплоемкостей веществ в интервале температур 298-498К составляют
-
H2 (г)
I2(г)
HI(г)

29,08
33,56
29,87
При 25С и 1 атм. изменение внутренней энергии системы в результате реакции
H2 (г)+ ½O2(г)= H2O(ж)
равно 282,1 кДж/моль. В интервале температур от 25С до 100С средние молярные теплоемкости H2 (г), O2(г) и H2O(ж) равны 28,9 29,4 и 75,5 Дж/мольК соответственно. Вычислите изменение энтальпии в реакции образования воды из простых веществ при 100С и 1 атм.
Стандартная энтальпия сгорания ацетилена меньше, чем стандартная энтальпия сгорания бутана:
сгор,298(C2H2(г))= 310,620 кДж/моль
сгор,298(C4H10(г))= 687,650 кДж/моль
Почему, несмотря на это, температура кислородно-ацетиленового пламени выше, чем кислородно-бутанового?
Стандартная энтальпия образования H2O(г) равна 241,82кДж/моль. Теплоемкость газообразной воды при 25С 33,58 Дж/мольК. Оцените максимальную температуру, которая может быть достигнута при горении стехиометрической смеси H2(г) и O2(г), если все выделяющееся тепло расходуется на нагревание паров воды (зависимостью теплоемкости от температуры пренебречь). Изменится ли максимальная температура при сжигании водорода не в чистом кислороде, а в воздухе, содержащем столько кислорода, сколько его требуется по уравнению реакции? Оцените эту температуру.
Если к розовым кристаллам шестиводного кобальта добавить жидкий тионилхлорид, то протекает бурная реакция, сопровождающаяся выделением большого количества газообразных продуктов, обезвоживанием хлорида кобальта (при этом розовые кристаллы превращаются в фиолетовые) и значительным охлаждением реакционной смеси.
CoCl26H2O(тв)+6SOCl2(ж)=CoCl2(тв)+6SO2(г)+12HCl(г)
Оцените минимальную температуру, которой может достигнуть реакционная смесь, если исходно реакцию проводят при 25С.
Поиск и подготовка – INPrint Labs, Inc. 2014
