
- •Закон Гесса
- •Вычисление теплового эффекта реакции при постоянном давлении. Два следствия из закона Гесса.
- •1.3 Вычисление теплового эффекта реакции при постоянном объеме.
- •1.4 Энтальпия растворения.
- •1.5 Энергия связи, энергия кристаллической решетки.
- •1.6 Количественные расчеты.
- •1.7 Зависимость теплового эффекта реакции от температуры проведения процесса. Теплоемкость.
Внимание!
Учебник находится на стадии открытого бета-тестирования. Не судите его строго. Правда, не надо.
Тепловые эффекты химических реакций

Белогурова Марина Анатольевна, к. х. н. и так далее :)
Оглавление
1.1 Закон Гесса 3
Задачи 7
1.2 Вычисление теплового эффекта реакции при постоянном давлении. Два следствия из закона Гесса. 10
Задачи 13
1.3 Вычисление теплового эффекта реакции при постоянном объеме. 15
Задачи 17
1.4 Энтальпия растворения. 18
Задачи 21
1.5 Энергия связи, энергия кристаллической решетки. 22
Задачи 29
1.6 Количественные расчеты. 30
Задачи 31
1.7 Зависимость теплового эффекта реакции от температуры проведения процесса. Теплоемкость. 34
Задачи 36
Закон Гесса
Независимость теплового эффекта реакции от химического пути проведения процесса при постоянном давлении называется законом Гесса. Этот закон позволяет рассчитать неизмеренное значение H химической реакции, если известны все другие значения H на некотором обходном пути осуществления процесса.
Пример 1
Образование оксида углерода (IV) из графита и кислорода можно рассматривать или как непосредственный результат взаимодействия простых веществ:
С(графит) +О2(г)=СО2(г), H1
или как результат процесса, протекающего через промежуточную стадию образования и сгорания оксида углерода (II):
С(графит) +½О2(г)=СО(г), H2
СО(г) +½О2(г)=СО2(г), H3.
Если сложить последние два уравнения (тепловой эффект, очевидно, также суммируется), то получим
С(графит) +О2(г)=СО2(г), H2+H3
С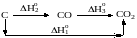 огласно
закону Гесса тепловые эффекты образования
CO2
как непосредственно из простых веществ,
так и через промежуточную стадию
образования и сгорания СО равны
огласно
закону Гесса тепловые эффекты образования
CO2
как непосредственно из простых веществ,
так и через промежуточную стадию
образования и сгорания СО равны
H1=H2+H3
Тепловые эффекты образования СО2 и горения СО можно измерить экспериментально (H1= 393,5 кДж/моль, H3.= 283,0 кДж/моль) Тепловой же эффект образования СО точно измерить затруднительно, так как при горении углерода в условиях недостатка кислорода образуется смесь CO и СО2. Тем не менее, тепловой эффект второй реакции можно найти исходя из закона Гесса:
H2=H1H3= 393,5(283,0)= 110,5 кДж/моль.
Внимание лицеистов! Я настаиваю на подобной форме записи решения: сначала пишется формула с требуемыми значениями стандартной энтальпии и правильными знаками, затем подставляются численные значения энтальпии со знаком в скобках (если требуется). Только затем производится расчет. Подобная форма записи убережет Вас от типичных ошибок в знаке слагаемого (90% ошибок в задачах по термохимии).
Химическое уравнение существенно отличается от алгебраического по смысловой нагрузке. Так уравнения a+b=c и c=a+b эквивалентны. Если же мы захотим подобным образом «перевернуть» химическое уравнение, мы с большой долей вероятности получим ересь. Водород и кислород охотно реагируют с образованием воды, выделяя при этом значительное количество тепла:
H2(г)+ ½O2(г)=H2O(ж) H1.
Вода же, к счастью всех живущих на Земле существ, до сих пор не была замечена в самопроизвольном разложении на водород и кислород
H2O(ж)=H2(г)+ ½О2(г) H2,
а потому, данное химическое уравнение на первый взгляд не имеет смысла. Я очень надеюсь на то, что на предыдущих уроках химии вы крепко-накрепко усвоили, что следует писать только те уравнения, которые хоть как-то соответствуют реальным процессам, а не просто удовлетворяют условию равенства числа атомов справа и слева. Только если это правило для вас очевидно и незыблемо, я позволю себе его нарушить.
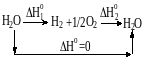 Давайте
отвлечемся от вопроса, идет или не идет
химическая реакция, и сосредоточимся
на вопросе о ее тепловом эффекте. В
задачах на нахождение теплового эффекта
по закону Гесса мы будем себе позволять
писать самые немыслимые (с точки зрения
грамотного химика) уравнения реакций,
интересуясь, в первую очередь, не
возможностью проведения подобного
процесса, а его тепловым эффектом.
Давайте
отвлечемся от вопроса, идет или не идет
химическая реакция, и сосредоточимся
на вопросе о ее тепловом эффекте. В
задачах на нахождение теплового эффекта
по закону Гесса мы будем себе позволять
писать самые немыслимые (с точки зрения
грамотного химика) уравнения реакций,
интересуясь, в первую очередь, не
возможностью проведения подобного
процесса, а его тепловым эффектом.
Согласно закону Гесса, если воду сначала разложить на водород и кислород, а потом из них снова образовать воду, то тепловой эффект реакции получения воды из воды (он, очевидно, равен нулю) будет равен сумме тепловых эффектов указанных реакций:
0=H1+H2
Таким образом, мы можем сделать вывод, что стандартная энтальпия обратной реакции равна по абсолютному значению и противоположна по знаку стандартной энтальпии прямой реакции.
H2= H1
В примере 1 мы наблюдали, что реакции можно складывать, и тепловые эффекты будут складываться. Сейчас мы убедились в том, что реакции можно условно «переворачивать», и стандартная энтальпия реакции поменяет знак. Кроме того, реакции можно домножать на необходимые коэффициенты, при этом тепловой эффект изменится пропорционально этим коэффициентам:
H2(г)+ ½O2(г)=H2O(ж) H1= 285,8 кДж/моль
2H2(г)+O2(г)=2H2O(ж) H3= 571,6 кДж/моль
H3=2H1
Действуя с химическими уравнениями так же, как и с алгебраическими (складывая, вычитая, домножая на коэффициенты), мы не разрешим вопрос о возможности прохождения новых результирующих процессов, но мы найдем их тепловые эффекты.
Пример 2
Требуется вычислить стандартную энтальпию образования пероксида водорода в водном растворе при 298 К, используя следующие термохимические уравнения:
(I) SnCl2(р-р*)
+ 2HCl(р-р) + H2O2(р-р)=
SnCl4(р-р)
+ 2H2O(ж) 
(II) SnCl2(р-р)
+ HCl(р-р)
+ HOCl(р-р)=
SnCl4(р-р)
+ H2O(ж) 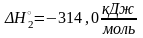
(III) 2HI(р-р)
+ HOCl(р-р) = I2(к)
+ HCl(р-р)
+ H2O(ж) 
(IV) ½H2(г)
+ ½I2(к)
(+
H2O(ж))=HI(р-р)
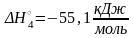
(V) H2(г)
+ ½O2(г)
= H2O(ж)
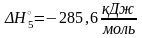
* здесь и далее в разделе «Тепловые эффекты химических реакций» под сокращением р-р подразумевается бесконечно разбавленный водный раствор.
Под стандартной энтальпией образования пероксида водорода в водном растворе подразумевается стандартная энтальпия реакции образования данного вещества из простых веществ:
(VI) H2(г)
+ O2(г)
(+
H2O(ж))
= H2O2(р-р)
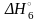
(Напоминаю, что вода, как бы проста ни казалась, простым веществом ни в коей мере не является, поэтому реакция Н2О+½О2=Н2О2 к делу не относится. В скобках вода указывается как среда, требуемая для образования раствора, а не как действующее вещество.)
Используя сложение, вычитание и умножение на коэффициенты, постараемся составить из известных реакций (I)-(V) такую комбинацию, чтобы в итоге получить искомое уравнение (VI). При этом стандартная энтальпия реакции (VI) H6 будет равен такой же алгебраической комбинации стандартных энтальпий реакций (I)-(V).
Искомый продукт реакции (H2O2(р-р)) присутствует только в первом уравнении, но не в продуктах, а в реагентах. Поэтому мы возьмем уравнение (I) в «перевернутом» виде, поменяв знак энтальпии на противоположный:
SnCl4(р-р)
+ 2H2O(ж)=SnCl2(р-р*)
+ 2HCl(р-р) + H2O2(р-р) 
При сравнении полученного результата с искомым уравнением (VI) возникает желание избавиться как минимум от хлоридов олова. Для этого сложим полученное уравнение с уравнением (II), при этом тепловые эффекта также сложатся:
SnCl4(р-р) + 2H2O(ж)=SnCl2(р-р*) + 2HCl(р-р) + H2O2(р-р)
SnCl2(р-р)
+ HCl(р-р)
+ HOCl(р-р)=
SnCl4(р-р)
+ H2O(ж) 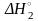
H2O(ж) + HOCl(р-р)= HCl(р-р) + H2O2(р-р) + |
В результирующем уравнении «лишними» являются хлорсодержащие кислоты. Чтобы избавиться от них, вычтем из полученного уравнения уравнение (III):
H2O(ж) + HOCl(р-р)= HCl(р-р) + H2O2(р-р) +
I2(к)
+ HCl(р-р)
+ H2O(ж)=
2HI(р-р) + HOCl(р-р) 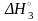
2H2O(ж) + I2(к) = 2HI(р-р) + H2O2(р-р) + |
Хочется еще раз обратить внимание на то, что уравнения, полученные алгебраической комбинацией нескольких химических реакций, не несут в себе химического смысла. Действительно, странно было бы ожидать от кристаллического йода взаимодействия с водой. Мы рассматриваем такие уравнения только как промежуточный этап расчета стандартной энтальпии образования некоторой реакции. В данном случае – реакции «получения» пероксида водорода из простых веществ, реакции еще более сомнительной для любого здравомыслящего химика, но полезной для термохимических расчетов.
В результирующем уравнении вместо хлора появился другой «лишний» элемент – йод. Чтобы избавится от йода, вычтем удвоенное уравнение (IV):
2H2O(ж) + I2(к) = 2HI(р-р) + H2O2(р-р) +
2HI(р-р)
=H2(г)
+ I2(к)
(+
H2O(ж)) 
2H2O(ж) = H2(г) + H2O2(р-р) (+ H2O(ж)) + |
Прибавляя удвоенное уравнение (V), приходим в итоге к следующему уравнению:
2H2O(ж) = H2(г) + H2O2(р-р) (+ H2O(ж)) +
2H2(г)
+ O2(г)
= 2H2O(ж)
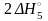
H2(г) + O2(г) = H2O2(р-р) (+ H2O(ж)) + + |
Мы получили искомое уравнение (VI), но с одним отличием: (+ H2O(ж)) стоит не с той стороны. Здесь уместно задать вопрос о том, что мы подразумеваем под данной записью. Если рассмотреть следующие уравнения реакций:
½H2(г) + ½I2(к) (+ H2O(ж))=HI(р-р)
½H2(г) + ½I2(г) (+ H2O(ж))=HI(р-р)
½H2(г) + ½I2(к) =HI(г)
½H2(г) + ½I2(г) =HI(г),
то все они будут иметь различный тепловой эффект, так как состояния веществ, участвующих в реакции различно.
Внимание! В задачах на закон Гесса с двух сторон уравнения можно сокращать одно и то же вещество только в одинаковом состоянии! Если в-во присутствует в разных состояниях, требуется использовать стандартную энтальпию перехода данного вещества из одного состояния в другое (стандартная энтальпия растворения, возгонки, перехода из одной аллотропной модификации в другую и т.д.)
Добавление слагаемого (+ H2O(ж)), хоть и встречается в ряде учебников, строго говоря, не является совсем правильным, так как не удовлетворяет равенству числа элементов в уравнении справа и слева. Но его все-таки пишут, чтобы подчеркнуть состояние результирующего вещества. А так как запись этого слагаемого является условной, мы можем просто вычеркнуть его из рассмотрения.
Внимание! Не следует сокращать воду в качестве среды (+ H2O(ж)) с водой в качестве действующего вещества +Н2О. При комбинации уравнений воду-среду можно мысленно вычеркнуть из уравнений, обращая пристальное внимание на состояния веществ (к, г, р-р).
Для самых въедливых лицеистов, желающих подумать о бесконечности, предлагаю найти более строгое объяснение, учитывая, что тепловой эффект двух реакций
2H2(г) + O2(г) = 2H2O(ж)
2H2(г) + O2(г) (+ H2O(ж)) = 2H2O(р-р)
одинаков.
Мы показали, что в примере 2 реакция (VI) может быть составлена как комбинация реакций (I)+(II)(III)2(IV)+2(V), соответственно, искомая стандартная энтальпия равна
= + + = (371,6)+(314,0)(215,2)2(55,1)+
+2(285,6)= 188,2 кДж/моль
Задачи
Вычислите стандартную энтальпию перехода графита в алмаз, если при образовании углекислого газа CO2 из графита выделяется 393,5 кДж/моль, а при образовании CO2 из алмаза выделяется 395,4 кДж/моль.
Исходя из стандартной энтальпии образования H2O(ж) и стандартной энтальпии реакции
H2O2(ж)=H2O(ж)+½O2(г) H298 = 98,3 кДж/моль,
вычислите стандартную энтальпию образования H2O2(ж).
Используя следующие термохимические уравнения,
KClO3(к)=KCl(к)+3/2O2(г) Hº298= 49,4 кДж/моль
KClO4(к)=KCl(к)+2O2(г) Hº298= 33 кДж/моль,
вычислите Hº298 реакции
4KClO3(к)= 3KClO4(к) + KCl(к)
Исходя из стандартных энтальпий реакций окисления As2O3 кислородом и озоном
As2O3(к)+O2(г)= As2O5(к) H298 = 271 кДж/моль;
As2O3(к)+2/3O3(г)= As2O5(к) H298 = 365 кДж/моль,
вычислите стандартную энтальпию образования озона.
На основании приведенных ниже данных вычислить стандартную энтальпию образования ZnSO4(к):
ZnS(к) = Zn(к) + S(ромб) H1= 183,9 кДж/моль
2ZnS(к) + 3O2(г) = 2ZnO(к) + 2SO2(г) H2= 927,5 кДж/моль
2SO2(г) + O2(г) = 2SO3(г) H3= 196,0 кДж/моль
ZnSO4(к) = ZnO(к) + SO3(г) H4= 230,3 кДж/моль
Вычислить изменение энтальпии в ходе реакции
CH4(г) + Cl2(г) = CH3Cl(г) + HCl(г)
зная изменение энтальпии H в ходе следующих реакций:
CH4(г) + 2O2(г) = CO2(г) + 2H2O(ж) H1= 889,5 кДж /моль
CH3Cl(г) + 3/2O2(г) = CO2(г) + H2O(ж) + HCl(г) H2= 685,5 кДж /моль
H2(г) + ½O2(г) = H2O(ж) H3= 285,6 кДж /моль
½H2(г) + ½Cl2(г) = HCl(г) H4= 92,2 кДж /моль
Используя приведенные ниже данные
2C(графит) + H2(г) = C2H2(г) H1 = +226,8 кДж/моль;
C(графит) + O2(г) = CO2(г) H2= 393,5 кДж /моль;
H2(г) + ½O2(г) = H2O(ж) H3= 285,6 кДж /моль;
CH3CHO(ж) + 2,5O2(г)=2CO2(г)+2H2O(ж) H4= 1167 кДж /моль,
вычислить H для процесса
C2H2(г)+H2O(ж)=CH3CHO(ж)
Найти на основании следующих данных стандартные энтальпии образования и сгорания этилена (C2H4(г)).
C2H4(г) + H2(г) = C2H6(г) H1= 136,8 кДж /моль
C2H6 (г)+ 7/2O2(г) =2CO2(г) +3H2O(ж) H2= 1570,9 кДж /моль
C(графит) + O2(г) = CO2(г) H3= 393,1 кДж /моль
H2(г) + ½O2(г) = H2O(ж) H4= 285,6 кДж /моль
Определить стандартную энтальпию образования As2O3 на основании следующих термохимических уравнений:
As2O3(к) + 3H2O(ж) (+H2O(ж)) = 2H3AsO3(р-р) H1= 31,61 кДж/моль
As(серый) + 3/2Cl2(г)=AsCl3(г) H2= 298,90 кДж/моль
AsCl3(г)+3H2O(ж)(+H2O(ж))=H3AsO3(р-р)+3HCl(р-р)H3= 73,60кДж/моль
½H2(г) + ½Cl2(г) = HCl(г) H4= 92,37 кДж/моль
HCl(г)(+H2O(ж)) =HCl(р-р) H5= 72,49 кДж/моль
H2(г) + ½O2(г) = H2O(ж) H6= 285,6 кДж/моль
Вычислите стандартную энтальпию образования водного раствора азотистой кислоты, воспользовавшись стандартными энтальпиями представленных реакций:
NH4NO2(р-р)=N2(г)+2H2O(ж) H1= 320,0кДж/моль;
NH3(р-р)+HNO2(р-р)= NH4NO2(р-р) H2= 37,7 кДж/моль;
NH3(р-р)=1/2N2(г)+3/2H2(г) H3= +84,9 кДж/моль;
H2(г) + ½O2 (г)= H2O(ж) H4= 285,6кДж/моль.
Вычислите стандартную энтальпию сгорания газообразного гидразина N2H4(г) на основании следующих термохимических уравнений:
2NH3(г) + 3N2O(г) = 4N2(г) + 3H2O(ж); H1= 1011,6 кДж/моль
N2O(г) + 3H2(г) = N2H4(г) + H2O(ж); H2= 272,7 кДж/моль
2NH3(г) + ½O2(г) = N2H4(г) + H2O(ж); H3= 98,3 кДж/моль
H2(г) + ½O2(г) = H2O(ж); H4= 285,6 кДж/моль
Используя следующие термохимические уравнения
H2(г) + ½O2(г) = H2O(ж) H1= 286 кДж/моль
Na(к)+H2O(ж)(+H2O(ж))=NaOH(р-р) + ½H2(г) H2= 231 кДж/моль
Na2O(к) + H2O(ж) (+ H2O(ж))= 2NaOH(р-р) H3= 282 кДж/моль
С(графит) + O2(г) = CO2(г) H4= 394 кДж/моль
Na2O(к) + CO2(г) = Na2CO3(к) H5= 320 кДж/моль,
вычислите стандартные энтальпии образования Na2O(к), NaOH(р-р) и Na2CO3(к).
Вычислить стандартную энтальпию образования I2O5(к), применяя закон Гесса (все величины даны в кДж/моль):
I2O5(к) + H2O(ж) (+ H2O(ж))= 2HIO3(р-р) H1= +3,6
KI(р-р) + 3HClO(р-р) = HIO3(р-р) + 2HCl(р-р) + KCl(р-р) H2= 322,1
NaOH(р-р) + HClO(р-р) = NaOCl(р-р) + H2O(ж) H3= 44,3
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O(ж) H4= 55,8
2NaOH(р-р) + Cl2(г) = NaOCl(р-р) + NaCl(р-р) + H2O(ж) H5= 99,7
2KI(р-р) + Cl2(г) = 2KCl(р-р) + I2(к) H6= 222,8
H2(г) + ½O2 (г)= H2O(ж) H7= 285,6
½H2(г) + ½Cl2(г) = HCl(г) H8= 92,2
HCl(г) (+ H2O(ж)) = HCl(р-р) H9= 75,1
