
Дисциплина: «Химия»
Специальность: «Общая медицина»
Курс 1
Студент должен владеть навыками:
приготовления растворов заданной концентрации, определения плотности и рН растворов;
приготовления буферных растворов с заданным значением рН, определения буферной емкости;
проведения качественных реакций на катионы и анионы биогенных элементов;
классификации органических соединений и проведения качественных реакций на функциональные группы.
Рубежный контроль №1
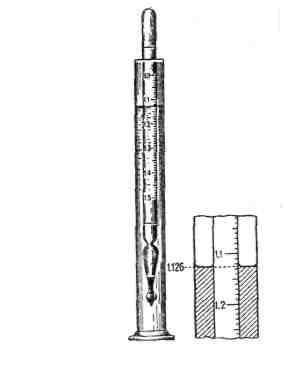
Опыт №1. Определение концентрации раствора по его плотности.
Реактивы и оборудование: исследуемый раствор (жидкость), цилиндры, набор ареометров.
В сухой стеклянный цилиндр налить исследуемый раствор на высоту ареометра (100-200мл) и опустить в него ареометр, шкала которого начинается с 1,00. Если при погружении ареометра шкала окажется полностью над жидкостью, то плотность раствора превышает величину шкалы ареометра. Замените ареометр следующим из набора (с большей плотностью) и так поступайте до тех пор, пока уровень жидкости в цилиндре окажется в пределах шкалы ареометра. Если при погружении ареометра шкала окажется полностью под жидкостью, замените ареометр следующим из набора (с плотностью меньше 1,00) и так поступайте до тех пор, пока уровень жидкости окажется в пределах шкалы ареометра. Плотность меньше 1,00 имеют многие органические жидкости и их растворы. Следите за тем, чтобы при измерении ареометр не касался стенок цилиндра. Отметьте по нижнему мениску деление шкалы ареометра, совпадающее с уровнем жидкости в цилиндре. Это и будет плотность раствора. Определение произведите 3 раза.
Используя таблицы, по плотности определите массовую долю (%) растворенного вещества в растворе. Затем проведите вычисление молярной концентрации и титра раствора. Масса растворенного вещества (mх) в 1 л раствора: mх = 10·%·d , (г)
Молярная концентрация раствора:

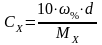 моль/л
моль/л
В этих формулах:
Мх – молярная масса вещества, г/моль,
% - массовая доля растворенного вещества, %,
d – плотность исследуемого раствора, г/мл.
Титр раствора:
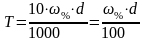 г/мл
г/мл
Опыт № 2. Приготовление раствора по навеске вещества, вычисление его эквивалентной концентрации.
Подготовить к работе мерную колбу и воронку, ополоснув их дистиллированной водой. (Если воронка сухая и чистая, то ополаскивать ее не надо).
Взять навеску вещества и через воронку перенести вещество в колбу. Струей воды из промывалки хорошо смыть вещество из воронки в колбу. Воронку убрать из колбы.
Заполнить колбу дистиллированной водой на 1/3 объема, круговыми движениями поворачивая колбу, повторить перемешивание раствора.
Добавить воды до 2/3 объема колбы, повторить перемешивание раствора
В колбу добавить воды из промывалки на 1-2 см ниже метки. Затем добавлять воду по каплям из пипетки до тех пор, пока нижний край мениска не станет на уровне метки.
Раствор в колбе закрыть пробкой и перемешать, много раз перевертывая колбу.
Вычислить эквивалентную концентрацию вещества по формуле:
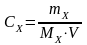 (моль/л);
MЭ
= f
Э·МХ
(моль/л);
MЭ
= f
Э·МХ
где mX – масса растворенного вещества, г
МХ - молярная масса растворенного вещества, г/моль
f Э - эквивалент вещества, моль
MЭ – молярная масса эквивалента вещества, г/ моль
V – объем раствора в литрах, л
Концентрацию раствора вычислить с точностью до 0,0001.
Указания к лабораторной работе №2
Тема: Определение теплоты растворения соли.
Приборы и реактивы: калориметр, мерный цилиндр, часы или секундомер, термометр, навеска соли, дистиллированная вода.
Выполнение работы:
1. Налить во внутренний сосуд калориметра 25 мл дистиллированной воды.
2. Опустить термометр во внутренний сосуд калориметра и, не касаясь его дна, измерить температуру воды (начальное значение t0 нач.)
3. Высыпать в сосуд с водой, через воронку навеску соли массой 1 г, закрыть крышкой с термометром, включить секундомер.
-







 Схема
калориметра:
Схема
калориметра:1-внутренний сосуд
2-теплоизолятор
3-термометр
4-мешалка
3 1
2
4
4. Осторожно перемешивать раствор мешалкой (делать круговые движения не касаясь термометра) и отмечать температуру через каждую минуту в течение 5-7 мин. Записать показания термометра в таблицу.
Время от начала опыта, мин
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Температура, 0С
|
|
|
|
|
|
|
|
|
5. Вылить содержимое сосуда промыть его водой.
ОБРАБОТКА РЕЗУЛЬТАТОВ:
1. Из данных таблицы найти t = tкон. - tнач.,
где tкон. – это минимальная или максимальная температура при растворении соли.
2.Рассчитать теплоту растворения 1 моль соли по формуле:
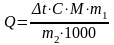 кДж/моль;
кДж/моль;
где m1 – масса раствора, г
m2 – масса соли, г
С = 4,184 кДж/град – удельная теплоемкость калориметра
М – молярная масса соли, г/моль
При расчетах использовать соотношение: Qраств. = - Нраств.
3. Записать понятие «теплота растворения»
4. Вычислить относительную ошибку измерения в процентах по формул
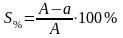
Где А – истинная (теоретическая) величина параметра,
а – величина параметра, полученная опытным путем
Теоретические значения энтальпии растворения соли:
ΔН раст. (NaNO3) = + 21,3 кДж/моль
ΔНраст. (Na2CO3) = - 23,6 кДж/моль
а - теплота (энтальпия) растворения соли, полученная опытным путем.
5.Оформить отчет по работе. Сделать вывод.
6. Рабочее место сдать дежурному.
