
- •Вступ План
- •Рекомендована література:
- •1. Значення металів та сплавів в промисловості
- •2. Роль предмету та зв’язок з іншими предметами
- •2. Бялик о.М., Черненко в.С., Писаренко в.М., Москаленко ю.Н. Металознавство м. ”Политехника”, 2002
- •3. Лахтин ю.М. „Металловедение” и „Термическая обработка металлов”; м „Металлургия”; 1979
- •1. Основні поняття
- •2. Природа сил міжатомного зв'язку
- •3. Іонний зв'язок
- •4. Атомно-кристалічна будова металів
- •5. Характеристики кубічної та гексагональної систем
- •Тема: 1.2. Кристалізація металів та будова злитку. План
- •Рекомендована література:
- •1. Самохоцкий а.Н. „Металловедение”, изд. Металургія, 1990, м.
- •2. Бялик о.М., Черненко в.С., Писаренко в.М., Москаленко ю.Н. Металознавство м. ”Политехника”, 2002
- •3. Лахтин ю.М. „Металловедение” и „Термическая обработка металлов”; м „Металлургия”; 1979
- •1 . Енергетичні умови процесу кристалізації
- •2 . Механізм кристалізації
- •3. Кінетика кристалізації
- •4. Форма і розміри кристалів
- •5. Будова металевого зливка
- •6. Ліквація, усадка при кристалізації
- •Тема: 1.3 Поліморфізм металів. План
- •Рекомендована література:
- •1. Самохоцкий а.Н. „Металловедение”, изд. Металургія, 1990, м.
- •2. Бялик о.М., Черненко в.С., Писаренко в.М., Москаленко ю.Н. Металознавство м. ”Политехника”, 2002
- •3. Лахтин ю.М. „Металловедение” и „Термическая обработка металлов”; м „Металлургия”; 1979
- •1. Анізотропія кристалів
- •2. Поліморфізм металів
- •2.1. Поліморфізм заліза
- •3. Дефекти кристалічної будови
- •3.1 Точкові дефекти
- •3.2 Дислокації
- •3.3 Поверхневі дефекти
- •3.4 Об'ємні дефекти
2. Природа сил міжатомного зв'язку
Фізика твердого тіла допускає спрощене уявлення про атоми як про сферичні частинки, пов'язані між собою дією міжатомних сил. Хімічна спорідненість між атомами передбачає наявність між ними сил притягання і відштовхування, їх рівнодійна обертається на нуль при певній рівноважній відстані між атомами, якій відповідає мінімум потенціальної енергії U.
Слід враховувати також вплив температури та тиску на сили міжатомного зв'язку. Цей зв'язок порушується, коли енергія теплових коливань перевершує потенціальну енергію U (глибину "потенціальної ями"). Чим міцнішими будуть міжатомні зв'язки, тим вищою повинна бути температура, щоб їх зруйнувати. Саме тому високі температури плавлення та випаровування відповідають міцним міжатомним і міжмолекулярним зв'язкам у рідкому та твердому станах.
3. Іонний зв'язок
Такий зв'язок базується на взаємному притяганні протилежно заряджених іонів. При утворенні таких сполук, як NаCl, MgS, КС1, KF тощо, атоми втрачають чи набувають електрони, що, у свою чергу, пов'язано з тенденцією до побудови найбільш стійких електронних конфігурацій - дублетів та октетів. Так, у випадку NаСl натрій втрачає слабко пов'язаний з ядром 3s електрон і перетворюється на позитивно заряджений іон Na+ з електронною конфігурацією, подібною до неону. атом хлору, приєднуючи цей один електрон, утворює негативно заряджений іон Сl з електронною структурою атома аргону. Отже, в обох випадках утворюється конфігурація сталого октету.
Характерною ознакою іонного зв'язку є відсутність будь-якої переважної спрямованості його в просторі. Тому кожен іон намагається оточити себе найбільшою кількістю іонів протилежного знака. Структура сполуки залежатиме від геометрії взаємного розташування іонів.
За умови електронейтральностї у кристалі NaCl кожен невеликий за розмірами іон натрію оточений шістьма більш крупними іонами хлору, розташованими у вершинах правильного октаедра. Кожен іон хлору також оточений шістьма октаедрично розташованими іонами натрію (мал. 1.1).
Д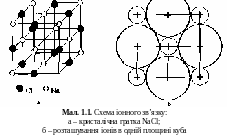 о
найбільш характерних властивостей
Іонних кристалів відносять високу
(близько 10! К) температуру плавлення,
велику теплоту сублімації (близько
106 Дж/моль). Високу механічну міцність
іонних кристалів на практиці важко
використати через їх високу крихкість.
о
найбільш характерних властивостей
Іонних кристалів відносять високу
(близько 10! К) температуру плавлення,
велику теплоту сублімації (близько
106 Дж/моль). Високу механічну міцність
іонних кристалів на практиці важко
використати через їх високу крихкість.
4. Атомно-кристалічна будова металів
Кристали — тверді тіла з дискретним та упорядкованим розташуванням атомів, які утворюють просторову кристалічну гратку. Експериментально доведено, що в кристалічних твердих тілах атоми знаходяться у вузлах кристалічної ґратки. Про це свідчать результати аналізу дифракції рентгенівського випромінювання та пучка прискорених електронів на цій гратці.
Кристалічну гратку можна побудувати, якщо подумки провести ряд систем паралельних площин, що перерізаються у просторі, і в кожній точці перерізу (вузлі) розмістити по атому (мал. 1.4). Будь-яку кристалічну гратку можна охарактеризувати її елементарною коміркою - мінімальною сукупністю атомів, трансляція якої в усіх трьох вимірах відтворює всю кристалічну гратку. На мал. 1.2, а елементарну комірку виділено потовщеними лініями.
Б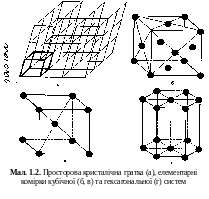 .
Федоров у 1889 році дав повний математичний
розрахунок 230 видів можливих просторових
груп, що складаються з 32 класів, об'єднаних
у 7 систем (сингоній).
Ця класифікація базується на використанні
шести величин - параметрів
ґратки:
трьох відрізків, що показують відстані
до найближчих атомів (іонів) уздовж
координатних осей: їх називають періодами
ґратки
та позначають літерами а,
b,
с;
і трьох кутів між цими відрізками, які
позначають першими літерами грецької
абетки α,
β, .
Для
кубічної залежність а
= b
= с, для
гексагональної а
= b
≠
с, а
кути для кубічної
α = β =
= 90°, гексагональної
– α = β =90°,
= 120°.
.
Федоров у 1889 році дав повний математичний
розрахунок 230 видів можливих просторових
груп, що складаються з 32 класів, об'єднаних
у 7 систем (сингоній).
Ця класифікація базується на використанні
шести величин - параметрів
ґратки:
трьох відрізків, що показують відстані
до найближчих атомів (іонів) уздовж
координатних осей: їх називають періодами
ґратки
та позначають літерами а,
b,
с;
і трьох кутів між цими відрізками, які
позначають першими літерами грецької
абетки α,
β, .
Для
кубічної залежність а
= b
= с, для
гексагональної а
= b
≠
с, а
кути для кубічної
α = β =
= 90°, гексагональної
– α = β =90°,
= 120°.
