
- •Практичні роботи з курсу «гідрогеологія»
- •Практична робота № 1
- •Форми виразу результатів хімічних аналізів
- •Еквіваленти та коефіцієнти реакції
- •Ступенем мінералізації:
- •Хід роботи
- •Вихідні дані для практичної роботи № 1
- •Практична робота № 2
- •Хід роботи
- •Вихідні дані для практичної роботи № 2
- •Практична робота № 3
- •Хід роботи
- •Гранулометричний склад порід
- •Гранулометричний склад порід
- •Дані для визначення коефіцієнту фільтрації
- •Практична робота № 4
- •Хід роботи
- •Дані для побудови карти гідроізогіпс
- •Вихідні дані для практичної роботи № 4
- •Практична робота № 5
- •Хід роботи
- •Дані для побудови карти гідроізоп’єз
- •Вихідні дані для практичної роботи № 5
- •Практична робота № 6
- •Хід роботи
- •1. Побудова гідрогеологічних розрізів
- •2. Аналіз гідрогеологічних розрізів
Ступенем мінералізації:
прісна – до 1 г/дм3;
слабо солона – 1-5 г/дм3;
солонувата – 5-10 г/дм3;
солона – 10-50 г/дм3;
–– розсоли – > 50 г/дм3.
Питна вода не повинна містити більше 1г/дм3 розчинених солей (в деяких південних районах за узгодженням із санепідслужбою допускається перевищення мінералізації до 2-3 г/дм3).
– за ступенем жорсткості:
–– дуже м'які – до 1,5 мг-экв/дм3;
–– м'які – 1,5-3,0 мг-экв/дм3;
–– жорсткі – 3,0-9,0 мг-экв/дм3
–– дуже жорсткі – 9 і більш мг-экв/дм3.
Для господарсько-питного водопостачання загальна жорсткість не повинна перевищувати 7 мг-экв/дм3 (з дозволу санепідслужби у виняткових випадках для водопостачання можуть бути використані підземні води із загальною жорсткістю до 10 мг-экп/дм3).
– за рН:
–– дуже кисла – <5;
–– кисла – від 5,0 до 6,9;
–– нейтральна – 7;
–– лужна – 7,1-9,0;
–– високолужна – > 9,0.
Для господарсько-питного водопостачання використовується вода з рН від 6,5 до 8,5. Визначити загальну жорсткість води можна, як суму катіонів кальцію і магнію в мг-экв.
Приклад розрахунку.
1) За даними хімічних аналізів мінералізація 0,6 г/дм3, рН = 7,9
– вміст аніонів, мг/дм3:
HCO3- = 400
Cl- = 71
SO42- = 19
– вміст катіонів, мг/дм3:
Ca2+ = 66
Mg2+ = 18
Na+ = 66
K+ = 1,5
2) переводимо результати у ваговій формі до міліграм-еквівалентної, мг-екв/дм3
– аніони:
HCO3- = 400/61,018 = 400×0,01639 = 6,556
Cl- = 71/35,475 = 71×0,0282 = 2,022
SO42- = 19/48,08 = 19×0,02082 = 0,39558
– Сума аніонів у мг-екв/ дм3 буде дорівнювати:
HCO3- + Cl- + SO42- = 6,556+2,022+0,39558 = 8,974 = 100%
– катіони:
Ca2+ = 66/20,040 = 66×0,0499 = 3,293
Mg2+ = 18/12,160 = 18×0,08224 = 1,480
Na+ = 66/22,997 = 66×0,04348 = 2,8697
K+ = 1,5/39,096 = 1,5×0,02558 = 0,0384
– Сума катіонів у мг-екв/ дм3 буде дорівнювати:
Ca2+ + Mg2+ + Na+ + K+ = 3,293+1,480+2,8697+0,0384 = 7,68 = 100%
3) загальна жорсткість:
Ca2+ (мг-екв) + Mg2 (мг-екв) = 3,293+1,480 = 4,77
4) переводимо результати з міліграм-еквівалентної до відсотково-еквіваленої форми, %-екв/дм3:
– аніони:
Сума аніонів (∑А), що дорівнює 8,974 приймаємо за 100%, а HCO3- у мг-екв/ дм3, що дорівнює 6,556 приймаємо за х (%-екв/ дм3) тоді:
∑А = 100%
HCO3-= х,
Звідки:

Аналогічно переводяться і інші аніони:

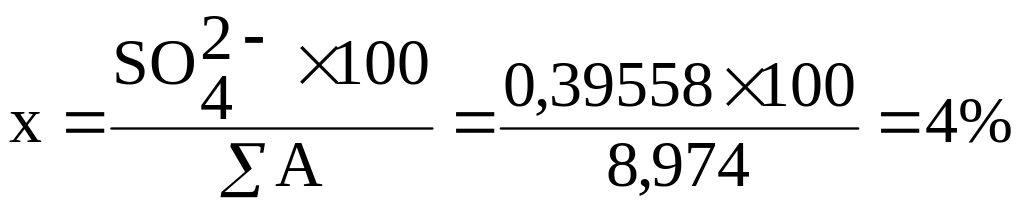
– катіони:
Сума катіонів (∑К), що дорівнює 7,68 приймаємо за 100%, а Ca2+ у мг-екв/ дм3,що дорівнює 3,293 приймаємо за х (%-екв/дм3), тоді:
∑К = 100%
Ca2+-= х,
Звідки:



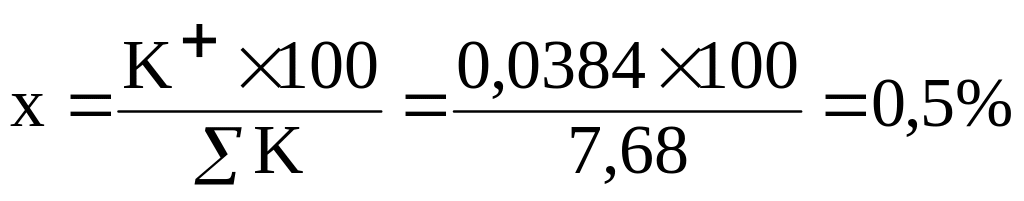
На практиці хімічний склад підземних вод найчастіше виражається формулою Курлова. Ця формула являє собою дріб, у чисельнику якого показаний вміст у відсотках-еквівалентах аніонів, а в знаменнику – катіонів у порядку зменшення їх кількості, вміст менший 10 %-екв не позначається. Ліворуч від дробу в грамах на 1 дм3 позначаються:
вміст деяких елементів і газів (г/дм3), кількість яких перевищує допустиму норму (Fe, J, Co);
загальна мінералізація (г/дм3).
У правій частині формули мають бути вказані значення рН, температура води у градусах Цельсія.
Отже, за вищезазначеним прикладом складемо формулу Курлова:
![]() .
.
В найменуванні складу води за М.Г. Курловим включаються аніони та катіони, вміст яких не перевищує 25%-екв. Причому, спочатку називаються аніони, потім катіони у спадному порядку [2].
За переважаючими головними аніонами водам привласнюють назви:
хлоридна, сульфатна, гідрокарбонатна, хлоридно-сульфатна, хлоридно-гідрокарбонатна, сульфатно-гідрокарбонатна і хлоридно-суфатно-гідрокарбонатна.
За переважаючими катіонами у воді привласнюються назви: натрієва, магнієва, кальцієва, натрієво-магнієва, натрієво-кальцієва, магнієво-кальцієва і натрієво-магнієво-кальцієва.
В наведеному прикладі найменування складу води буде:
гідрокарбонатна кальцієво-натрієва.
Гідрокарбонатна кальцієво-натрієва вода за зазначеними вище класифікаціями буде: прісна, жорстка, лужна.
