- •5.3. Рибонуклеиновая кислота (рнк)
- •5.3.1. Рибосомная рнк (рРнк)
- •5.3.2. Матричная, или информационная, или мессенджер рнк (мРнк или иРнк)
- •5.3.3. Транспортная рнк (тРнк)
- •5.4. Процессы с участием нуклеиновых кислот: репликация, транскрипция и трансляция
- •5.4.1. Репликация (редупликация)
- •5.4.2. Репарация днк
- •5.4.3. Транскрипция
- •В присутствии лактозы (положительная индукция):
- •В отсутствии лактозы (отрицательная индукция):
- •5.4.4. Трансляция
- •5.4.5. Особенности строения генов эукариот
- •5.4.6. Процессинг белков
- •6. Обмен веществ и энергии в организме
- •6.1. Обмен белков
- •6.1.1. Расщепление белков в процессе пищеварения
5.4.6. Процессинг белков
Процессинг белков – это посттрансляционные модификации, которым подвергается новосинтезированный белок («созревание» белка). Модификация белков обычно происходит при их прохождении через биомембрану. Например, пробелок (белок-предшественник) может содержать 15-20 гидрофобных аминокислотных остатков на N-конце, которые при прохождении через биомембрану отщепятся под действием протеаз (ферментов-гидролаз).
Виды химических модификаций белка:
гидролиз;
гликозилирование (присоединение к молекуле белка углеводного фрагмента, т.е. образование сложного белка – гликопротеина);
фосфорилирование (присоединение к молекуле белка остатка фосфорной кислоты).
Процессинг белков происходит в аппарате Гольджи клетки, в котором помимо модификации белков проходит их маркировка и сортировка. Химическая модификация белков протекает при их движении с «цис»-стороны к «транс»-стороне аппарата Гольджи.
Значение процессинга:
1) предшественники белков могут быть функционально неактивными, их функция «включается» при достижении ими клетки-мишени;
2) в ходе процессинга обеспечивается определенная пространственная структура («закрутка») белка.
Примеры процессинга белков:
в поджелудочной железе синтезируется трипсиноген – неактивный предшественник трипсина. В кишечнике от него отщепляются 6 активных остатков с N-конца молекулы под действием специального фермента – энтеропептидазы;
в ходе синтеза пептидного гормона – инсулина – сначала образуется его предшественник – препроинсулин, от которого затем отщепляется сигнальная последовательность и синтезируется проинсулин. Дальнейшая модификация проинсулина изменяет его пространственную структуру, происходит сближение остатков цис, которые в инсулине образуют дисульфидные мостики, кроме того вырезается фрагмент С-пептида. Функционально активный инсулин представляет собой двухцепочечный полипептид, в котором А-цепь (21 аминокислотный остаток) и В-цепь (30 аминокислотных остатков) связаны дисульфидными мостиками.
6. Обмен веществ и энергии в организме
Обмен веществ и обмен энергии составляют сущность жизнедеятельности любого организма.
Обмен веществ – непрерывный, самосовершающийся и саморегулируемый круговорот веществ, протекающий в процессе существования живой материи и сопровождающийся ее постоянным самообновлением. Это необходимый атрибут живой материи.
Жизнь – особая, качественно отличная от других биологическая форма движения материи, которая характеризуется существованием саморегулирующихся и самовоспроизводящих систем, обменивающихся с окружающей средой веществом и энергией (Ю. Б. Филиппович).
Пути обмена веществ


анаболизм (ассимиляция, синтез) – поглощение, накопление и усвоение организмом веществ из окружающей среды |
катаболизм (диссимиляция, распад) – разрушение веществ, составляющих организм, и выведение продуктов распада в окружающую среду |
Диалектическое единство противоположностей: питание выделение, синтез распад, анаболизм метаболизм катаболизм.
Метаболизм – предмет динамической биохимии – промежуточный обмен веществ, та часть обмена веществ в организме, которая заключается в осуществлении химических реакций, ведущих к преобразованию индивидуальных химических соединений при их распаде и синтезе в процессе жизнедеятельности организма.
Обмен веществ невозможен без сопутствующего ему обмена энергии. Главные материальные носители энергии in vivo – химические связи между атомами в молекулах органических соединений. Понятие «энергия связи» по-разному трактуется в физической химии и в биохимии. С точки зрения физической химии, энергия связи – это энергия, необходимая для ее разрыва, т. е. чем устойчивее химическая связь, тем выше энергия связи. Биохимики нередко называют «макроэргической» (высоко энергетической) связь, которая не отличается высокой прочностью и легко освобождает энергию в процессе реакции с другими соединениями. Целый ряд органических молекул обладают такими макроэргическими фосфатными связями, для которых характерна большая отрицательная величина ΔG0 гидролиза. Например, аденозинтрифосфорная кислота (АТФ):

Макроэргические связи в соединениях принято обозначать значком ~. В состав АТФ входит три фосфатные группы, но только две из них способны легко отщепляться в процессе гидролиза (см. схему).

Ниже приведены примеры макроэргических соединений (макроэргов), содержащих фосфатные связи, и даны величины стандартной свободной энергии их гидролиза.
Стандартная свободная энергия гидролиза
макроэргических соединений
Соединение |
ΔG0, кДж/моль |
|
название |
структура |
|
Фосфоенолпировиноградная кислота |
|
61.9 |
1,3-Дифосфоглицериновая кислота |
|
49.4 |
Ацетилфосфорная кислота |
CH3COO~PO(OH)2 |
42.3 |
АТФ |
См. выше |
32.5 |
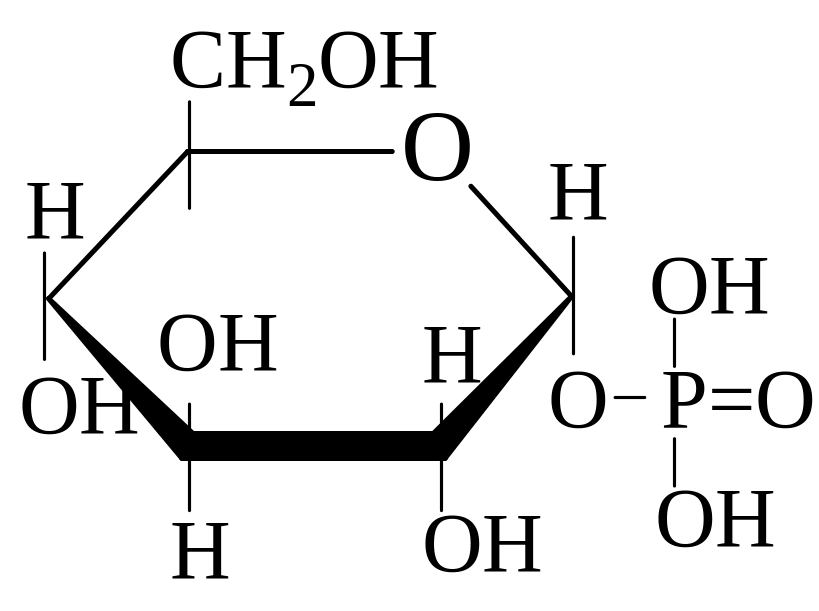
Глюкозо-1-фосфорная кислота |
|
20.9 |
Глюкозо-6-фосфорная кислота |
|
13.8 |
Глицеро-1-фосфорная кислота |
|
9.2 |
Из таблицы видно, что АТФ занимает промежуточное положение в ряду рассматриваемых соединений, т.е. она способна без труда отщеплять фосфат-ион с образованием АДФ (аденозиндифосфорной кислоты). В свою очередь АДФ способна легко присоединять фосфатную группу, давая опять АТФ. Таким образом, система АТФ–АДФ играет роль фосфатного «челнока»: АДФ может присоединить фосфатную группу от соединения с большей энергией ΔG0, например, от ацетилфосфата (см. табл.), превращаясь при этом в АТФ, а затем перенести ее на соответствующий акцептор (например, на молекулу глицерина), образуя соединение, более бедное энергий (глицеро-1-фосфат). Этим объясняется ключевая роль АТФ в переносе энергии в живой природе.
Еще одним широко распространенным in vivo макроэргическим соединением является ацетилкоэнзим А (ΔG0 = -32,9 кДж/моль).

Макроэргические связи – это, в основном, сложноэфирные связи (тиоэфирные, ангидридные, фосфоамидные). В их образовании, как правило, участвуют 2 «макроэргических элемента»: S и Р.
Масштабы обмена веществ in vivo: ежедневно на Земле разрушается до СО2 и Н2О около 1 млрд. т органических соединений. Полное обновление биомассы Земли происходит за 200 лет (В. А. Ковда, 1966). Человек за 40 лет (от 30 до 70), не меняя массы тела (70 кг), перерабатывает ~ 6 т пищи и 36 850 л воды.
Обмен веществ обмен энергии – это единый и неразрывный процесс.
Общая схема обмена веществ и обмена энергии