
- •4.12. Макро- и микроэлементы и их биологические функции
- •5. Нуклеиновые кислоты
- •5.1. Строение нуклеиновых кислот
- •1) Азотистые основания
- •Кето-енольная таутомерия азотистых оснований
- •Молекулярная масса нуклеиновых кислот
- •Нуклеозиды и нуклеотиды
- •Номенклатура нуклеозидов и нуклеотидов
- •Строение полинуклеотида
- •Состав нуклеиновых кислот
- •5.2. Дезоксирибонуклеиновая кислота (днк)
- •5.2.1. Первичная структура днк
- •5.2.2. Вторичная структура днк
- •5.2.3. Третичная структура днк
- •Классификация днк (в зависимости от места локализации в клетке):
5.2. Дезоксирибонуклеиновая кислота (днк)
5.2.1. Первичная структура днк
Первичная структура ДНК представлена двухцепочечными полидезоксирибонуклеотидами с уникальным сочетанием дезоксирибонуклеотидных остатков (дАМФ, дТМФ, дГМФ, дЦМФ).
Например, ген человеческого лейкоцитарного интерферона состоит из 520 дезоксирибонуклеотидных остатков:
ТГТ ТЦТ ЦТГ ГГЦ ТГТ…
Структура ДНК лучше изучена у прокариот (например, E.coli), т.к. ее легче извлечь, сняв мембранную оболочку, в нативной форме. Однако, в середине 70-х годов прошлого столетия были разработаны методы изучения первичной структуры ДНК (ДНК-секвенирование, от англ. sequence – последовательность):
энзиматический (или метод полимерного копирования): в 1975 г. Ф. Сангер (он же в 1953 г. открыл первичную структуру инсулина) и Р. Коулсон предложили получать набор копий ДНК (убывающих по числу нуклеотидных остатков) при помощи ДНК-полимеразной реакции. При помощи фермента (ДНК-полимеразы) синтезировались копии ДНК, заканчивающиеся на одном из нуклеотидов. В 1976 г. таким образом была определена структура гена фага Х 174 (5 375 п.н.).

ддНТФ – «брачный» нуклеозидтрифосфат (2’,3’-дидезоксирибонук-леозидтрифосфат): в связи с тем, что в положении 3’ монозы отсутствует ОН-группа, такой нуклеотид не способен к образованию 3’-5’ фосфодиэфирной связи, поэтому происходит обрыв синтезируемой цепи ДНК. Например, структура ддГТФ:

Таким образом, получают набор фрагментов с одинаковыми концом (например, Г), затем при помощи электрофореза в ПААГ (полиакриламидном геле) анализируют образующиеся фрагменты и проводят статистический анализ результатов с целью определения нуклеотидной последовательности ДНК-матрицы;
химический метод (1977 г.): А. Максам и В. Гильберт предложили избирательно расщеплять цепь ДНК по месту модифицированных пуриновых и пиримидиновых оснований (одного или двух): 5’ или 3’-конец ДНК метится радиоактивным изотопом 32Р, затем цепь ДНК обрабатывают специальным химическим веществом (например, диметилсульфатом (СН3)2SO4), вызывающим структурные изменения в одном из азотистых оснований, что приводит к обрыву цепи по месту модификации азотистого основания (например, Г).
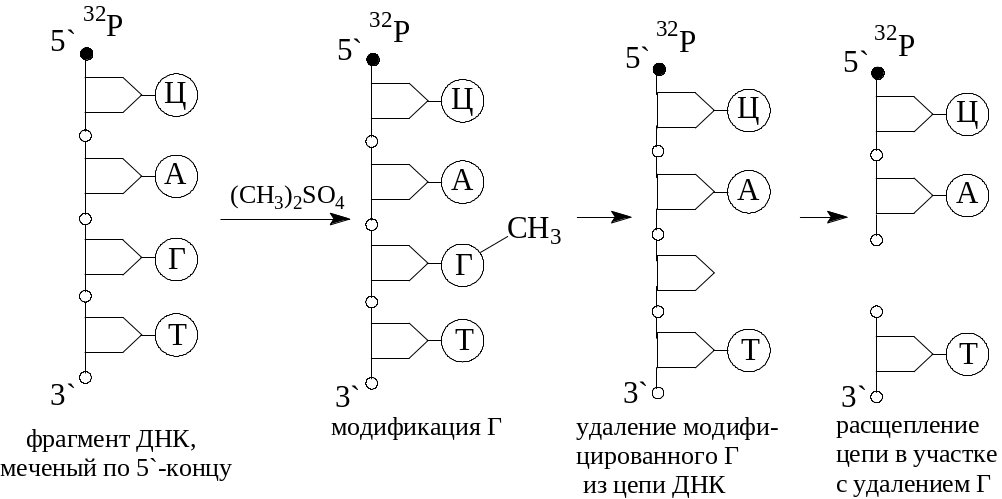
Анализ полученных фрагментов ДНК проводят, как и в методе (1).
5.2.2. Вторичная структура днк
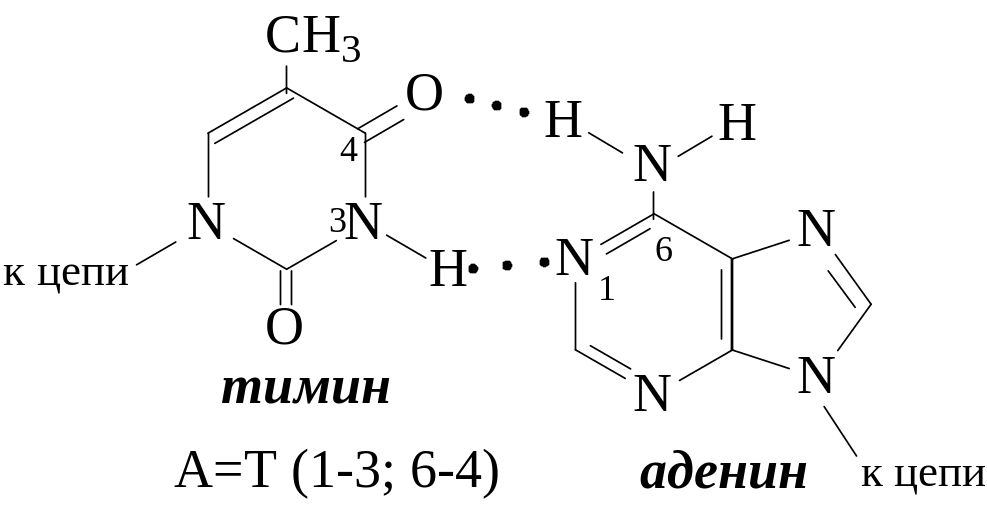
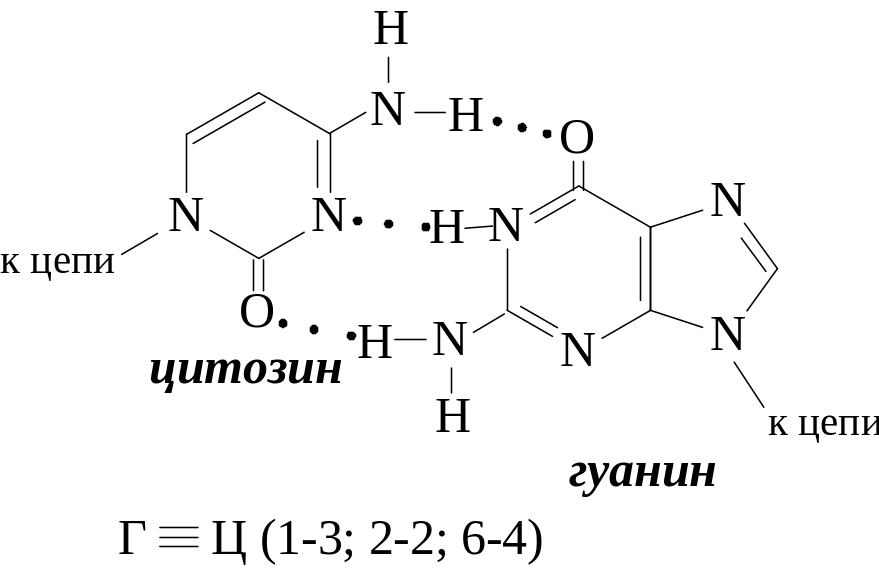
Вторичная структура ДНК была открыта в 1953 г. Д. Уотсоном и Ф. Криком: двойная спираль, состоящая из двух антипараллельных полинуклеотидных цепей. Азотистые основания, принадлежащие двум цепочкам, избирательно присоединяются водородными связями:

П
В
![]()
Таким образом, цепи ДНК являются антипараллельными: для лейкоцентарного человеческого интерферона:
1 цепь: АТЦ ТГТ ТЦТ ЦТГ ГГЦ ТГТ ~ в цепь
2 цепь: ТАГ АЦА АГА ГАЦ ЦЦГ АЦА ~ в цепь
Особенности вторичной структуры ДНК отражают правила Э. Чаргаффа (1950):
Сумма пуриновых нуклеотидов равна сумме пиримидиновых нуклеотидов: ПУР = ПИР.
Молярное содержание аденина равно молярному содержанию тимина: А = Т.
Молярное содержание гуанина равно молярному содержанию цитозина: Г = Ц.
Количество аденина и цитозина равно количеству гуанина и тимина: А+Ц = Г+Т.
В ДНК из различных источников соотношение нуклеотидов неодинаково, возможно: А+Т Ц+Г (АТ-тип ДНК)
Г+Ц А+Т (ГЦ-тип ДНК)
![]() -
коэффициент видоспецифичности. На
основании правил Э. Чаргафф выдвинул
положение о видовой специфичности ДНК
по нуклеотидному составу.
-
коэффициент видоспецифичности. На
основании правил Э. Чаргафф выдвинул
положение о видовой специфичности ДНК
по нуклеотидному составу.
