
- •4.7. Классификация и номенклатура ферментов
- •Классы ферментов
- •4.8. Локализация ферментов в отдельных органах и тканях
- •4.9. Применение ферментов:
- •4.10. Коферменты (коэнзимы)
- •Коферменты
- •4.11. Витамины
- •Витамины
- •4.11.1. Жирорастворимые витамины
- •4.11.2. Водорастворимые витамины
- •4.11.3. Групповая характеристика некоторых витаминов
где I – ингибитор, EI – фермент-ингибиторный комплекс (ФИК).
Конкурентное ингибирование широко применяется в фармакологии. Например, сульфаниламиды (синтетические антибактериальные вещества: сульфадимезин, норсульфазол, этазол, бисептол, гросептол, септрин и т.д.) являются конкурентами п-аминобензойной кислоты,
![]()
которая используется бактериями для синтеза фолиевой кислоты – фактора их роста. Сульфаниламиды тормозят ферментативную реакцию синтеза фолиевой кислоты благодаря конкуренции с п-амино-бензойной кислотой.

Сульфаниламиды подавляют жизнедеятельность микрофлоры кишечника, вырабатывающей витамины. Поэтому их применяют в комплексе с поливитаминами.
б) неконкурентные обратимые ингибиторы – связываются с ферментом вне активного центра, уменьшают его концентрацию, изменяют конформацию фермента замедляется связывание субстрата. Ингибитор не затрагивает зону связывания субстрата, а инактивирует каталитический центр фермента:
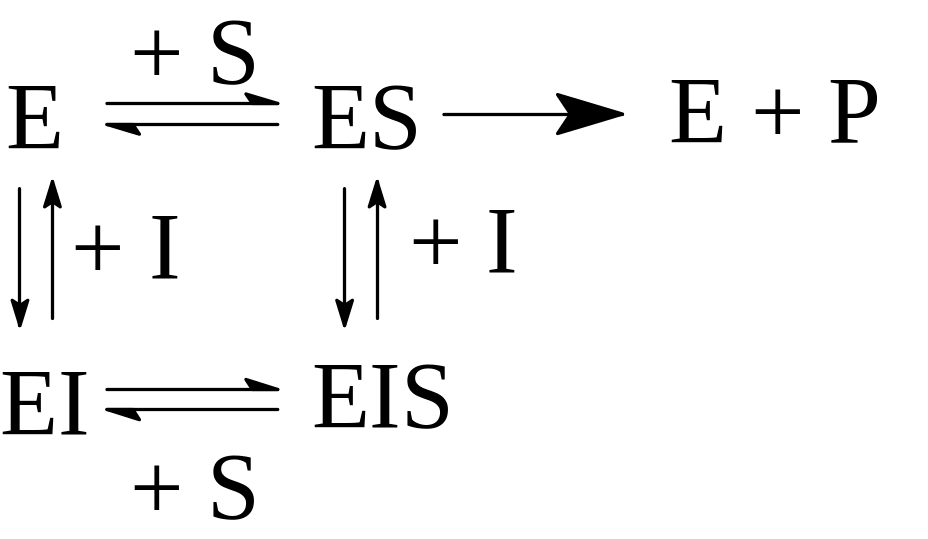
в) бесконкурентные обратимые ингибиторы обратимо взаимодействуют с ферментом после образования ФСК:
![]()
В этом случае ингибитор препятствует распаду фермент-субстратного комплекса и образованию продукта ферментативной реакции.
4.7. Классификация и номенклатура ферментов
В 1961 г. Международная комиссия по ферментам разработала классификацию, согласно которой все ферменты делятся на шесть классов в соответствии с типом катализируемых ими реакций.
Каждый фермент имеет свой четырехзначный шифр, который отражает принадлежность данного фермента к классу (первая цифра), подклассу (вторая цифра), подподклассу (группе) (третья цифра), четвертая цифра соответствует порядковому номеру фермента в группе. Например, глюкозооксидаза: КФ.1.1.3.4. (-аза – суффикс фермента).
Классы ферментов
Оксидоредуктазы. Катализируют окислительно-восстановительные реакции.

Тривиальное название: дегидрогеназы – ферменты, отщепляющие водород.
Если А = О2, то ферменты называются оксидазы.
Если А = Н2О2, то ферменты называются пероксидазы.
Подкласс 1.1 СН-ОН – группа доноров (например, алкоголь-дегидрогеназа).
Подкласс 1.2 С=О или О=С-Н – группа доноров (альдегидо- или кетонная группа доноров).
Подкласс 1.4 СН-NH2 – группа доноров.
Трансферазы. Катализируют реакции переноса группировок с одного соединения на другое.
Подкласс 2.1 – переносят одноуглеродные остатки: СН3, ОСН3, СООН и др.
Подкласс 2.2 – переносят альдегидо- и кетонные остатки.
Подкласс 2.3 (ацилтрансферазы) – переносят кислотные радикалы.
Подкласс 2.4 (гликозилтрансферазы) – переносят гликозильные остатки (ферменты, участвующие в синтезе полисахаридов).
Подкласс 2.6 (аминотрансферазы) – переносят группы, содержащие азот.
Подкласс 2.7 (фосфотрансферазы) – переносят группы, содержащие фосфор.
Подкласс 2.8 – переносят группы, содержащие серу.
Гидролазы. Ускоряют гидролитическое расщепление веществ.
Подкласс 3.1 – гидролизуют сложноэфирные связи (например, эстеразы, фосфотазы, нуклеазы).
Подкласс 3.2 – гидролизуют гликозильные связи: амилазы, - и -глюкозидаза и др.
Подкласс 3.4 – гидролизуют пептидные связи (отщепляют N‑концевую аминокислоту – аминопептидазы; С-концевую аминокислоту – карбоксипептидазы).
Подкласс 3.5 – гидролизуют C-N связи, отличные от пептидных (например, амидные): аспарагеназа, уреаза.
Подкласс 3.7 – гидролизуют С-С связи (оксалоацетаза).
Лиазы. Катализируют реакции негидролитического расщепления с образованием двойных связей или реакции присоединения по двойным связям:
С-С-лиазы (оксалоацетатдекарбоксилаза);
С-О-лиазы (карбоангидраза);
С-N-лиазы.
Типичная реакция:
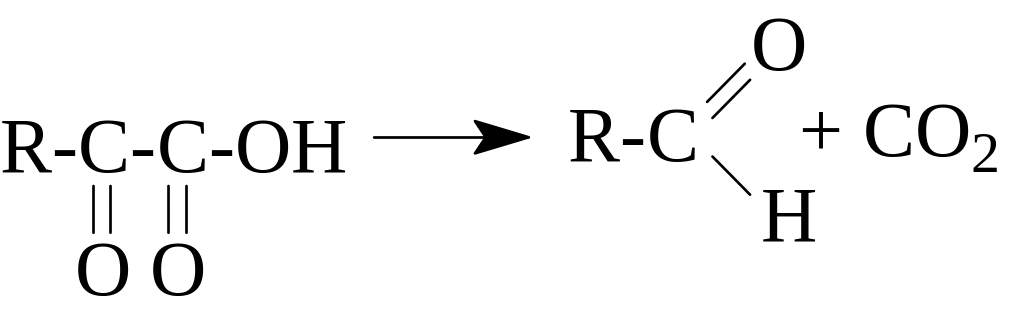
Изомеразы. Катализируют реакции изомеризации соединений.
5.1 Рацемазы и эпимеразы
5.2 Цис-транс-изомеразы
5.3 Внутримолекулярные оксидоредуктазы (ускоряют кето-енольные таутомерные превращения)
Лигазы (синтетазы). Ускоряют реакции синтеза с использованием энергии макроэргических соединений (АТФ и др.).
6.1 Образуют С-О-связи (аминоацил-тРНК-синтетаза)
6.2 Образуют C-S-связи
6.3 Образуют C-N-связи (участвуют в синтезе амидов)
6.4 Образуют С-С-связи (карбоксилазы)
Все процессы сопряжены с распадом. АТФ.
Общая
схема:
![]()
4.8. Локализация ферментов в отдельных органах и тканях
Все организмы отличаются не только по морфологическим и анатомическим признакам, но и по «набору» ферментов. Например, только для фотосинтезирующих организмов характерны ферменты метаболизма зеленых пигментов, для человека и животных – ферменты тромбин и плазмин.
Внутри клетки ферменты содержатся и действуют в строго определенных органеллах (компартментах).
Ядро |
Ферменты синтеза нуклеиновых кислот: - и -ДНК-полимеразы, РНК-полимераза |
Цитоплазма |
Ферменты гликолиза
|
Матрикс митохондрий |
Ферменты -окисления жирных кислот
|
Лизосомы |
Гидролазы
|
Пероксисомы |
Ферменты утилизации Н2О2, оксидазы
|
Хлоропласты (растительная клетка) |
АТФазы, ферменты синтеза углеводов из СО2 |
