
- •3.5. Молекулярная масса белков и методы ее определения Молекулярная масса белка
- •Методы определения молекулярной массы
- •3.6. Оптические свойства белков
- •3.7. Амфотерные свойства белков
- •Изоэлектрические точки некоторых белков
- •3.8. Определение аминокислотной последовательности полипептидных цепей
- •3.9. Номенклатура и классификация белков
- •Простые белки
- •Сложные белки
- •3.10. Функции белков in vivo
- •4. Ферменты (энзимы)
- •4.1. История открытия и изучения ферментов
- •4.2. Общие и специфические свойства ферментов
- •4.3. Строение ферментов
- •Строение простого фермента
- •Аллостерические эффекторы
- •4.4. Механизм действия ферментов
- •Общая схема:
- •4.5. Скорость ферментативных реакций
- •Влияние различных факторов на скорость ферментативных реакций:
- •4.6. Ингибиторы ферментов
гель-проникающая (молекулярно-ситовая) хроматография (позволяет разделять белки в соответствии с размерами их молекул. В качестве неподвижной фазы используют пористые материалы (синтетические смолы, пористое стекло – биоглас, пористый кварц – порасил, производные полисахаридов на основе декстрана – сефадекс, агарозы – сефароза, синтетического полимера полиакриламида – биогель Р и др.).
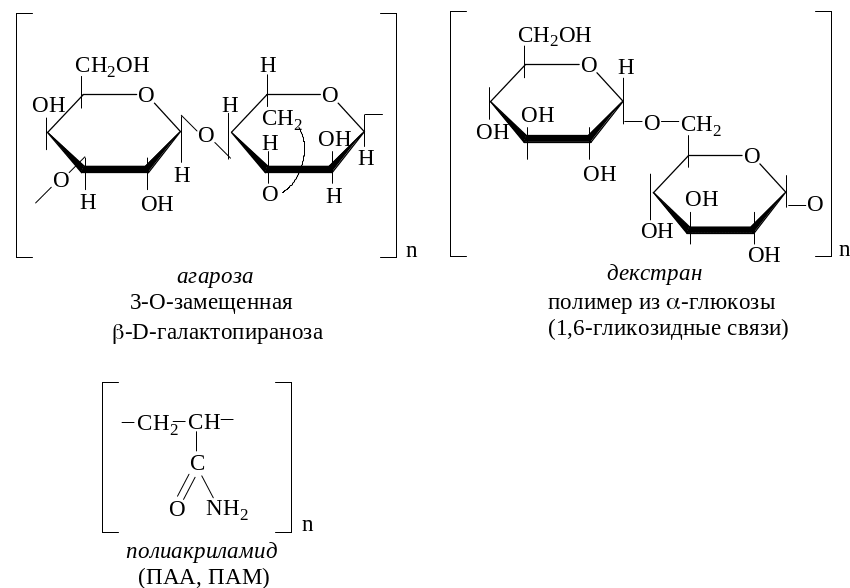

В зависимости от размеров (и молекулярной массы) время прохождения белковых молекул через колонку будет разным, следовательно, можно разделить фракции: первыми из колонки выходят более крупные белки, затем – более мелкие (т. к. они проникают в поры сефадекса и удерживаются в них).
аффинная (от англ. affinity – сродство) хроматография (биоспецифическая адсорбционная хроматография). Основана на специфическом взаимодействии выделяемого вещества (белка, фермента) со специфическими веществами (лигандами: антиген, кофактор, рецептор и др.), закрепленными на матрице.
И
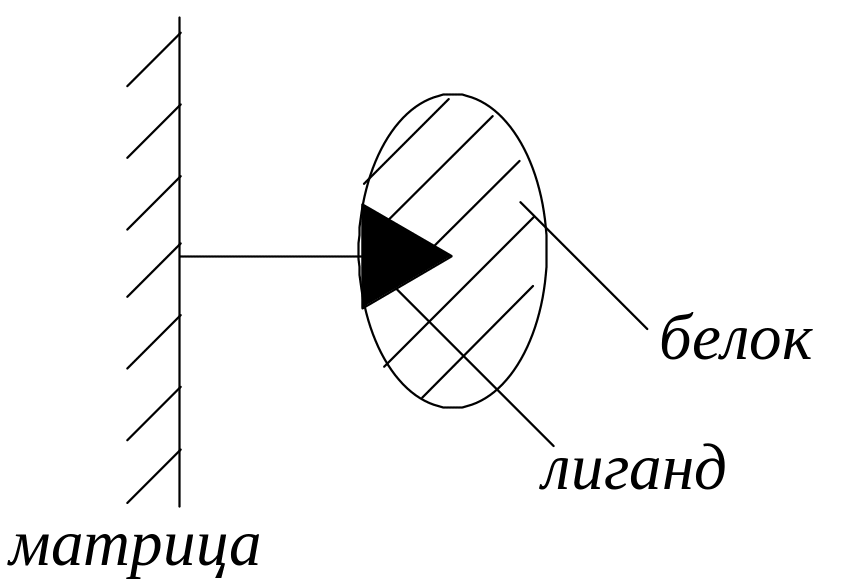
4) очистка белков.
Выделенные описанными выше способами белки, как правило, содержат низкомолекулярные примеси. Для очистки применяют следующие методы:
диализ;
электродиализ (возле полупроницаемых мембран диализной камеры помещают электроды, на которые подают напряжение);
гель-фильтрация (на сефадексе);
ультрафильтрация (сжатым газом через калиброванную полупроницаемую мембрану продавливается белковый раствор – белок остается на мембране, низкомолекулярные соединения проходят сквозь поры);
кристаллизация и перекристаллизация (с помощью этих процедур достигается высокая степень чистоты). В 1906 г. русский химик А. Д. Розенфельд впервые закристаллизовал оксидазу, в 1926 г. американский ученый Д. Самнер – уреазу.
3.5. Молекулярная масса белков и методы ее определения Молекулярная масса белка


физическое значение молекулярной массы (определяется физическими методами с точностью 100-1000 а.е.м.) |
химическое значение молекулярной массы (для белков с расшифрованной первичной структурой, точность: 10-2 а.е.м.) |
Методы определения молекулярной массы
гравиметрический (идея этого метода была высказана русским химиком Думанским А. В. в 1913 г.; шведский химик Сведберг Т. в 1923 г. сконструировал прибор: ультрацентрифугу с оптической приставкой).
Молекулярная масса определяется по скорости оседания белковых частиц. Исследуемый раствор белка помещают в кварцевую ячейку и включают центрифугу. Фотоприставка фиксирует содержимое ячейки через определенные промежутки времени.
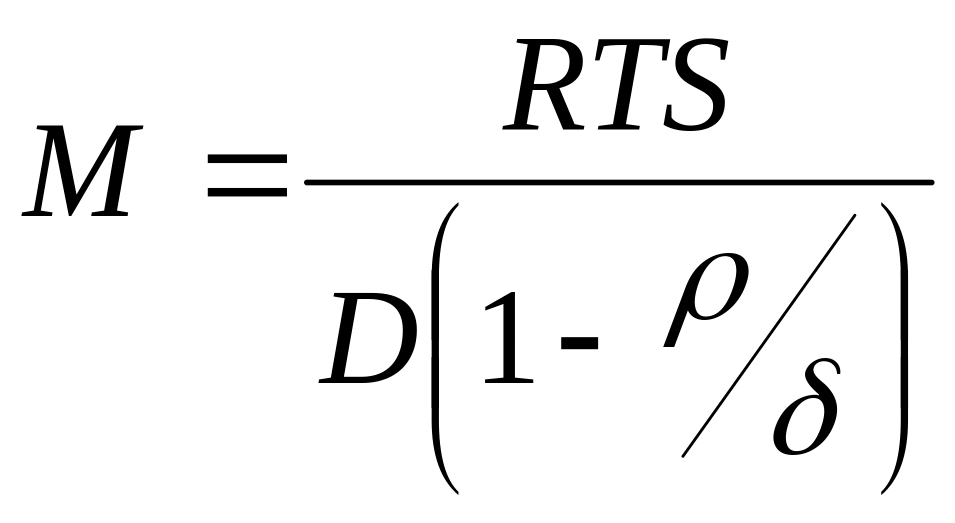 ,
,
где М – молярная масса; R – универсальная газовая постоянная; D – коэффициент диффузии; S – постоянная седиментации (определяется экспериментально); - плотность растворителя; - плотность белковых частиц;
гель-фильтрационный
![]() ,
,
где l – длина пробега белка в тонком слое сефадекса;
электрофоретический:
,
где l – длина пробега белка при электрофорезе в полиакриламидном геле;
п
 о
осмотическому давлению;
о
осмотическому давлению;
по вязкости;
по данным рентгеноструктурного анализа; используются
по данным электронной микроскопии; редко
по светорассеянию.
3.6. Оптические свойства белков
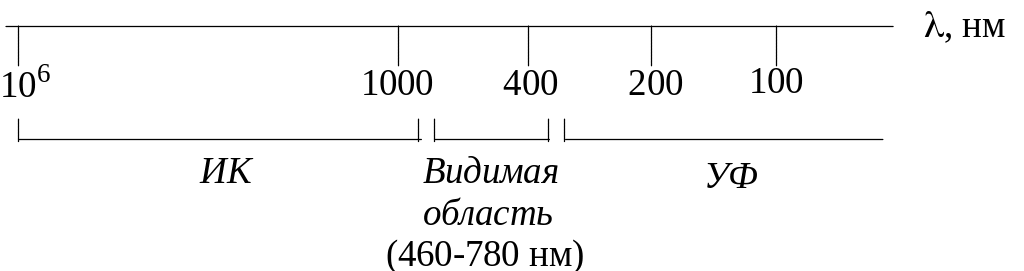
Как правило, все белки поглощают УФ свет в трех областях: наиболее интенсивно при = 280 нм, при = 210-250 нм и при = 190 нм. На этом свойстве основан спектрофотометрический метод количественного определения белков: метод не очень точный, но простой, поэтому широко применяется. При толщине кюветы 1 см и = 280 нм 1 единица оптической плотности соответствует 1 мг белка на 1 мл раствора.
В видимой области спектра поглощают окрашенные белки, например, гемоглобины, цитохромы, флавопротеины, «голубой белок» из Pseudomonas и др.
В ИК области поглощают все белки, это используется при определении ориентации водородных связей.
Белки – оптически активны (т. к. содержат хиральные атомы углерода), следовательно, они вращают плоскость проходящего через них плоскополяризованного света.
Для белков характерно явление оптической анизотропии – различие оптических свойств по разным направлениям (обусловлена внутренним строением, конформацией).
Белковые растворы способны флуоресцировать (испускать квант света h при переходе из возбужденного в основное электронное состояние). Флуоресцируют, как правило, белки, содержащие остатки ароматических аминокислот: три, тир, фен.
3.7. Амфотерные свойства белков
Белки – амфотерные электролиты, т. к. в их состав входят амфотерные аминокислоты. В нейтральной среде аминокислоты существуют в виде биполярных ионов:

В растворах аминокислоты могут вести себя как основания (акцепторы протонов):
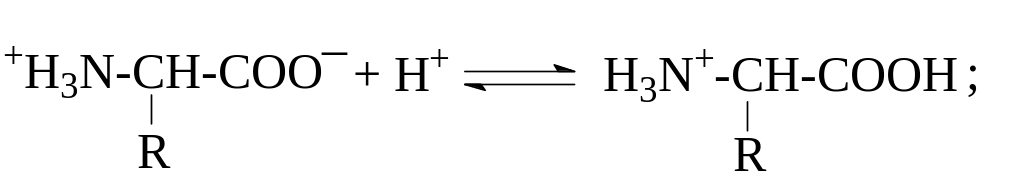
либо как кислоты (доноры протонов):
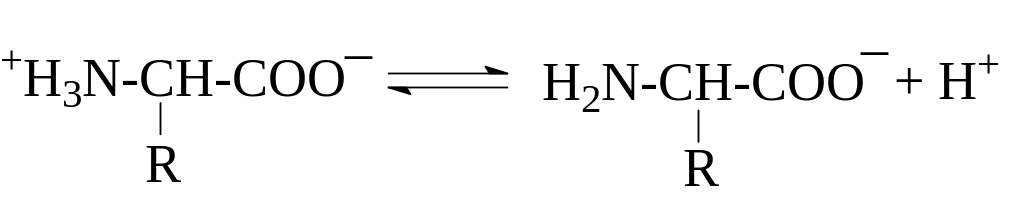
Влияние положительно заряженной аммонийной группы в ‑положении делает -карбоксильную группу значительно более сильной по сравнению с карбоксилом алифатических кислот. Так, если рКа уксусной кислоты составляет 4,7, то у глицина рКа карбоксила равен 2,34. Близкие значения имеют рКа карбоксильных групп и других -аминокислот (см. табл.). -Аминогруппа в -аминокислотах испытывает влияние карбоксилат-иона и становится значительно менее основной, чем аминогруппа первичных алифатических аминов – ее рКа равен 9,6 – 9,7 в отличие от 10,7 для этиламина.
Аминокислоты |
рК1 |
рК2 |
рНI |
Глицин D, L-аланин D, L-фенилаланин D, L-серин rac-серин D, L-валин L-валин D, L-лейцин D, L-изолейцин L-пролин |
2,35 2,35 2,58 2,21 2,19 2,29 2,48 2,33 2,32 2,00 |
9,78 9,87 9,24 9,15 9,21 9,72 9,71 9,74 9,76 10,60 |
6,06 6,11 5,91 5,68 5,70 6,00 6,10 6,04 6,04 6,30 |
На рис. изображен вид кривой титрования 0,1 М раствора аланина 0,1 М раствором NaOH.
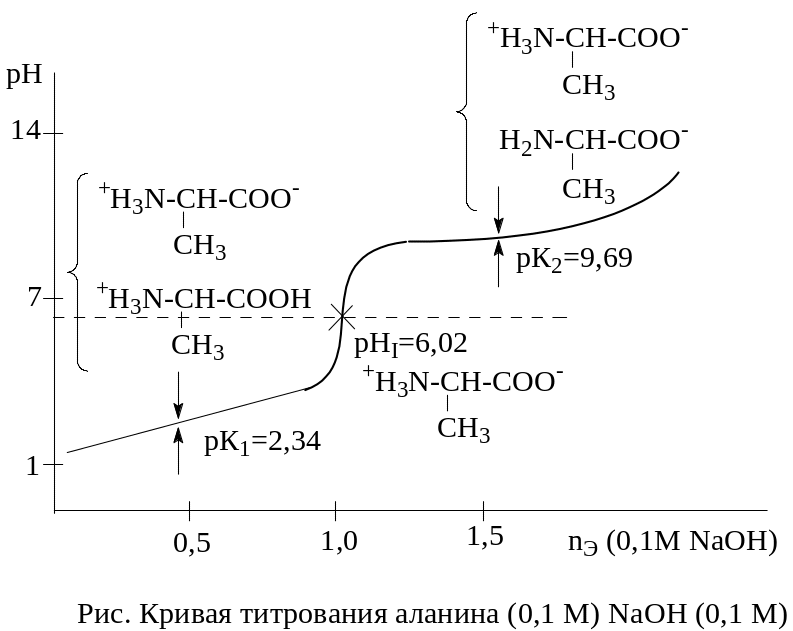

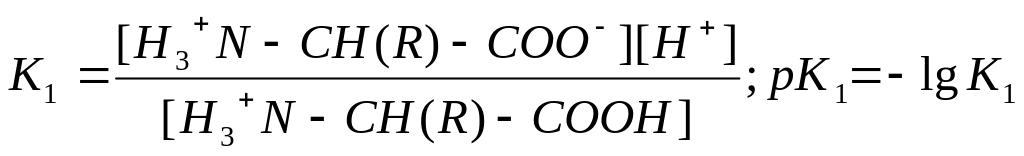
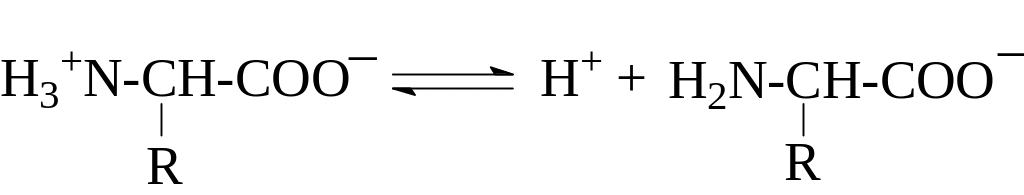

Кислотно-основные свойства белков определяются, в основном, R-группами аминокислотных остатков, вклад N- и с-концов незначителен. Заряд белковых молекул зависит от рН среды.
Изоэлектрическая точка (ИЭТ) – значение рН, при котором белок не несет суммарного заряда и не движется в электрическом поле.
