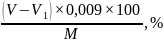- •Введение в технологию продуктов питания
- •Введение
- •Лабораторная работа № 1 анализ качества сахара-песка теоретические основы
- •Физико-химические показатели качества сахара-песка и сахара-рафинада (гост 21-94)
- •Экспериментальная часть
- •1.1. Определение внешнего вида сахара
- •1.2.Определение привкуса, чистоты раствора и запаха сахара
- •2. Физико-химические параметры качества сахара
- •Последовательность выполнения работы
- •Получаемые результаты
- •Результаты определения массовой доли сахарозы
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение массовой доли влаги сахара
- •Последовательность выполнения работы
- •Получаемые результаты
- •Результаты определения массовой доли редуцирующих веществ
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение массовой доли золы в сахаре-песке
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение массовой доли ферропримесей в сахаре-песке
- •Содержание отчета
- •Результаты оценки качества сахара-песка по физико-химическим параметрам
- •Контрольные вопросы
- •Лабораторная работа №2 анализ крахмальной патоки
- •Требования к качеству крахмальной патоки
- •Экспериментальная часть
- •1. Приготовление основного раствора патоки
- •Последовательность выполнения работы
- •2.1. Определение массовой доли сухих веществ карамельной патоки (I способ)
- •Последовательность выполнения работы
- •Коэффициент пересчета при рефрактометрическом определении сухого вещества патоки по показаниям сахариметра при поляризации основного раствора патоки
- •Получаемые результаты
- •Результаты определения массовой доли сухих веществ на рефрактометре рпл-3
- •2.2. Определение массовой доли сухих веществ всех видов патоки (II способ)
- •Последовательность выполнения работы
- •Температурные поправки к показаниям лабораторного рефрактометра при отклонении от температуры 20°с
- •Значения массовой доли редуцирующих веществ патоки и коэффициентов пересчета
- •Получаемые результаты
- •Результаты определения массовой доли сухих веществ на рефрактометре рпл-2
- •2.3.1. Определение массовой доли редуцирующих веществ поляриметрическим методом
- •Последовательность выполнения работы
- •2.3.2 Определение массовой доли редуцирующих веществ йодометрическим методом (Вильштеттера и Шудля)
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение массовой доли редуцирующих веществ иодометрическим методом
- •Последовательность выполнения работы
- •Последовательность выполнения работы
- •Получаемые результаты
- •Результаты определения массовой доли золы
- •Последовательность выполнения работы
- •Получаемые результаты
- •Результаты определения кислотности патоки
- •Содержание отчета
- •Результаты определения физико-химических показателей качества патоки
- •Контрольные вопросы
- •Лабораторная работа № 3 анализ качества пищевых жиров и масел
- •Экспериментальная часть
- •Последовательность выполнения работы
- •Последовательность выполнения работы
- •Оценка масла по цветности
- •Последовательность выполнения работы
- •2. Изучение физико-химических параметров оценки качества пищевых жиров и масел
- •Получаемые результаты
- •Определение массовой доли влаги масла
- •Последовательность выполнения работы
- •Получаемые результаты
- •Результаты определения кислотного числа исследуемого масла
- •2.3. Определение кислотности жира
- •Последовательность выполнения работы
- •Получаемые результаты
- •Результаты определения числа омыления
- •2.5. Определение иодного числа (гост р исо 3961-2010)
- •2.5.1. Определение иодного числа методом Маргошеса
- •Последовательность выполнения работы
- •Получаемые результаты
- •Результаты определения йодного числа методом Маргошеса
- •2.5.2. Быстрый рефрактометрический метод определения иодного числа
- •Получаемые результаты
- •Результаты определения йодного числарефрактометрическим методом
- •2.6. Определение массовой доли поваренной соли в маргарине и коровьем масле (гост р 52253-2004)
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение массовой доли поваренной соли в сливочном масле
- •Содержание отчета
- •Результаты определения физико-химических показателей качества пищевых жиров и масел
- •Контрольные вопросы
- •Экспериментальная часть
- •Приготовление помадных конфет
- •Соотношение сахара, патоки и температуры охлаждения помадного сиропа
- •Определение качества помадных конфет
- •Результаты оценки качества полученных помадных конфет по органолептическим и физико-химическим показателям
- •Контрольные вопросы
- •2. Приготовление и определение качества карамели
- •Экспериментальная часть
- •Приготовление карамели
- •Рецептура карамели
- •Определение качества карамели
- •Результаты оценки качества полученной карамели по органолептическим и физико-химическим показателям
- •Экспериментальная часть
- •Приготовление печенья
- •Рецептура сахарного и затяжного печенья
- •Приготовление теста для сахарного печенья
- •Приготовление теста для затяжного печенья
- •Разделка и выпечка
- •1. Органолептические показатели качества печенья
- •Результаты определения органолептических показателей качества сахарного и затяжного печенья
- •2. Физико-химические показатели качества печенья
- •Получаемые результаты
- •Определение массовой доли влаги сахарного и затяжного печенья
- •Получаемые результаты
- •Определение щелочности сахарного и затяжного печенья
- •Получаемые результаты
- •Результаты определения намокаемости сахарного и затяжного печенья
- •Содержание отчета
- •Результаты определения качества сахарного и затяжного печенья по органолептическим и физико-химическим показателям
- •Контрольные вопросы
- •Лабораторная работа № 6 анализ качества пшеничной муки
- •1.Определение количества и качества
- •Экспериментальная часть
- •Зависимость объема воды от массы навески
- •Характеристика клейковины и группы качества зерна пшеницы
- •Получаемые результаты
- •Определение массовой доли сырой клейковины в пшеничной муке
- •Определение качества сырой клейковины в пшеничной муке
- •Содержание отчета
- •Контрольные вопросы
- •2. Определение массовой доли влаги в муке
- •Экспериментальная часть
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение массовой доли влаги в муке
- •Содержание отчета
- •Контрольные вопросы
- •3. Определение кислотности муки по болтушке
- •Экспериментальная часть
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение титруемой кислотности муки
- •Экспериментальная часть
- •Зависимость массы навески от влажности муки
- •Получаемые результаты
- •Определение числа падения образца муки
- •Содержание отчета
- •Контрольные вопросы
- •Лабораторная работа № 7 анализ качества ячменного солода
- •Основные показатели качества ячменного солода
- •Экспериментальная часть
- •1. Органолептические показатели качества ячменного солода
- •1.1. Определение запаха и вкуса ячменного солода
- •Последовательность выполнения работы
- •1.2. Определение внешнего вида и цвета ячменного солода
- •Последовательность выполнения работы
- •Получаемые результаты
- •Органолептические показатели качества ячменного солода
- •2. Физико-химические показатели качества ячменного солода
- •2.1. Натура ячменного солода
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение натуры ячменного солода
- •2.2. Абсолютная масса ячменного солода
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение массы 1000 зерен
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение тонкости помола ячменного солода
- •2.4. Определение массовой доли влаги в солоде
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение массовой доли влаги ускоренным методом
- •Последовательность выполнения работы
- •Получаемые результаты
- •Результаты определения относительной плотности солодового сусла пикнометрическим методом
- •Зависимость экстрактивности вытяжки солода (е, мас. %) от относительной плотности фильтрата
- •Последовательность выполнения работы
- •Получаемые результаты
- •Определение кислотности солода
- •Содержание отчета
- •Контрольные вопросы
- •8. Гост 5194-91. Патока крахмальная. Технические условия.
- •Оглавление
- •Введение в технологию продуктов питания
- •443100, Г. Самара, ул. Молодогвардейская, 244. Главный корпус
- •443100, Г. Самара, ул. Молодогвардейская, 244. Корпус № 8
2.3.2 Определение массовой доли редуцирующих веществ йодометрическим методом (Вильштеттера и Шудля)
Метод основан на том, что иод в щелочной среде количественно окисляет альдосахара в соответствующие одноосновные кислоты, кетозы при этом не изменяются. Окислительное действие щелочного раствора иода происходит по схеме: I2+2е=2I-. Избыток иода, не вошедшего в реакцию с сахарами, оттитровывают тиосульфатом натрия:
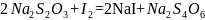
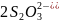 +
+
Последовательность выполнения работы
В мерную колбу вместимостью 100 см3 вносят пипеткой 10 см3 основного раствора патоки, доливают до метки дистиллированной водой и перемешивают. Из полученного раствора берут пипеткой 10 см3, помещают в коническую колбу вместимостью 250-400 см3, вносят пипеткой 25 см3 0,1М раствора иода и из бюретки медленно (по каплям) приливают 30 см3 0,1М раствора гидроксида натрия. Содержимое колбы хорошо перемешивают, закрывают пробкой или часовым стеклом и оставляют на 15-20 мин в темном месте. Затем прибавляют 4,5-5 см3 1М раствора H2SO4 и титруют 0,1М раствором тиосульфата натрия до светло-желтого окрашивания, после чего добавляют 1 см3 1%-ного раствора крахмала и продолжают титрование до обесцвечивания. Параллельно ставят контрольную пробу. В коническую колбу пипеткой вносят 10 см3 дистиллированной воды, 25 см3 0,1 М раствора иода, из бюретки приливают 30 см3 0,1 М раствора гидроксида натрия, оставляют на 15-20 мин, подкисляют 4,5-5 см3 1 М раствора H2SO4 и титруют тиосульфатом натрия в присутствии крахмального раствора. Расхождение между параллельными определениями не должно превышать 0,5%. Массовая доля редуцирующих веществ определяется по формуле:
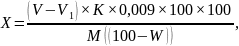
где X – массовая доля редуцирующих веществ в патоке в пересчете на сухие вещества, %; V – количество 0,1 М раствора тиосульфата натрия, пошедшее на титрование 25 см3 0,1 М раствора иода (контрольный опыт), см3; V1 – количество 0,1 М раствора тиосульфата натрия, пошедшее на титрование остатка иода после взаимодействия с редуцирующими веществами патоки, см3;К – поправочный коэффициент 0,1 М раствора тиосульфата натрия; 0,009 – количество глюкозы, соответствующее 1 см3 0,1 М раствора иода или 0,1 М раствора тиосульфата натрия, г: М – масса патоки, взятая для определения редуцирующих веществ, г; W – массовая доля влаги в патоке, %.
Получаемые результаты
Студентам необходимо определить массовую долю редуцирующих веществ патоки двумя способами, заполнить табл. 2.8 и 2.9, а также сравнить полученные результаты с данными ГОСТ 5194-91 и сделать свои выводы.
Таблица 2.9
Определение массовой доли редуцирующих веществ иодометрическим методом
Изучаемые показатели |
Полученные результаты |
Количество 0,1 М раствора тиосульфата натрия, пошедшее на титрование 25 см3 0,1 М раствора иода (контрольная проба) (V), см3 |
|
Количество 0,1 М раствора тиосульфата натрия, пошедшее на титрование остатка иода после взаимодействия с редуцирующими веществами патоки (V1), см3 |
|
Количество 0,1 М раствора иода, вступившее во взаимодействие с редуцирующими веществами патоки (поправочный коэффициент 0,1 М раствора тиосульфата натрия) [(V— V1)К], см3 |
|
Масса патоки, взятая для определения редуцирующих веществ (в 10 см3 разбавленного раствора) (М), г |
|
Количество глюкозы в М г патоки [(V—V1)Kх0,009], г |
|
Массовая доля
глюкозы в патоке при ее фактической
массовой доле влаги |
|
Массовая доля влаги (W) % |
|
Массовая доля глюкозы в пересчете на сухие вещества патоки(X), % |
|
2.4. Определение температуры карамельной пробы (ГОСТ Р 52060-2003)
Температуру карамельной пробы определяют для карамельной и низкоосахаренной патоки.