
- •Лекция 38 (часть 1) Растворение и экстрагирование в системе твердое тело-жидкость
- •38.1. Общие сведения
- •38.2. Растворение полностью растворимых веществ
- •38.2.1. Основы кинетики растворения.
- •38.2.2. Интенсификация процессов растворения.
- •38.3. Экстрагирование растворенного вещества
- •38.3.1. Кинетика экстрагирования растворенного вещества
- •38.4. Экстрагирование твердого вещества
- •Лекция 38 (часть 2) Способы экстрагирования и растворения
- •38.5. Способы экстрагирования и растворения
- •38.6. Устройство аппаратов для растворения и экстракции
- •38.7. Основы расчета установки экстрагирования
- •Одноступенчатое экстрагирование из твердого тела
- •Многоступенчатое экстрагирование в перекрестном токе
- •Многоступенчатая противоточная экстракция
Лекция 38 (часть 1) Растворение и экстрагирование в системе твердое тело-жидкость
38.1. Общие сведения
Массообменные процессы между жидкостями или парогазовыми смесями и твердым телом широко представлены в химических, пищевых, фармацевтических и других производствах. В связи с тем, что твердая фаза представляет собой совокупность дискретных частиц различной формы и размера, массоперенос в объеме каждой из них происходит в нестационарном режиме с изменением концентрации целевого компонента как от точки к точке, так и во времени.
Под растворением понимают переход вещества в раствор с поверхности частиц. Обычно этот процесс проводят с целью разделения системы, состоящей из растворимых и инертных частиц. При этом предполагается, что растворимые частицы отделены от инертных, а последние не оказывают существенного влияния ни на кинетику растворения, ни на конечные результаты процесса. При обычном физическом растворении исходное твердое вещество может быть вновь получено кристаллизацией из раствора.
Химическое растворение представляет собой гетерогенную химическую реакцию, продукты которой растворяются в жидком объеме. Возврат к исходному твердому веществу путем кристаллизации здесь невозможен. В условиях химического растворения могут образовываться твердые или газообразные продукты реакции, значительно осложняющие кинетику растворения. Экранизация поверхности растворения твердыми продуктами реакции существенно замедляет процесс, а выделение газообразной фазы ускоряет растворение до определенных пределов, за которыми становится заметным экранирующее действие газовой фазы. Процессы растворения протекают обычно достаточно быстро. Этому способствует непосредственный контакт движущейся (перемешиваемой) жидкости с поверхностью растворяющихся частиц.
Экстрагированием называется процесс извлечения одного или нескольких компонентов из твердого материала путем избирательного растворения в жидкостях (экстрагентах). Извлекаемые компоненты содержатся в порах твердого тела в виде растворенного вещества или в виде твердой фазы. В первом случае говорят об экстрагировании растворенного вещества, во втором – об экстрагировании твердого вещества.
Экстрагирование твердого вещества кинетически неравноценно его растворению. В условиях растворения вещество непосредственно контактирует с движущейся жидкостью, благодаря чему сопротивление массопереносу невелико. В условиях экстрагирования твердого вещества область, содержащая целевой компонент, первоначально занимает весь объем частицы, а с ходом экстрагирования систематически сокращается.
38.2. Растворение полностью растворимых веществ
В процессе растворения происходит под действием растворителя процесс разрушения структуры твердого вещества и переход его в жидкую фазу с образованием, как правило, однородного раствора, состоящего из растворителя и распределенных в нем молекул ионов растворенного вещества и их структурных образований с растворителем (гидратов и сольватов).
При некоторой определенной концентрации вещества в жидком растворителе, называемой концентрацией насыщения или растворимостью, между твердой фазой этого вещества и его раствором устанавливается равновесие. Из химической термодинамики известно, что равновесие имеет место, когда химический потенциал вещества в растворе равен химическому потенциалу этого вещества в его твердом состоянии. На базе этого условия в принципе должны рассчитываться значения концентраций насыщения (С*). Однако практически для большинства реальных пар твердое вещество – растворитель значения концентраций насыщения, в наибольшей степени зависящие от температуры, определены экспериментально и приведены в справочной литературе по равновесию (растворимости).
Концентрация насыщения представляет собой важный физико-химический и технологический параметр, поскольку эта величина характеризует способность растворителя воспринимать растворяемое вещество и, кроме того, наряду с другими факторами растворимость в значительной степени влияет на скорость процесса перехода вещества в раствор.
Растворение твердых веществ в жидких растворителях возможно только в тех случаях, когда действительная концентрация (C) растворяемого вещества в растворе меньше концентрации насыщения (С < С*).
Процесс растворения чистых индивидуальных веществ обычно происходит на наружной поверхности растворяемых частиц этого вещества, поэтому для увеличения скорости растворения следует увеличивать общую поверхность растворяющейся твердой фазы путем измельчения растворяемого вещества до частиц размером несколько миллиметров и менее.
Скорость растворения чистого вещества пропорциональна разности концентраций (С* – С) и обратно пропорциональна сумме сопротивлений всех трех последовательных стадий процесса: диффузионного подвода растворителя из его основной массы к поверхности растворения через пограничный слой, перехода вещества из исходного твердофазного в растворенное состояние непосредственно на самой поверхности растворения и диффузионного отвода растворенного вещества от поверхности растворения в основную массу растворителя (раствора).
В принципе, могут быть существенны сопротивления всех трех стадий, но нередки случаи, когда одно из сопротивлений значительно превосходит сумму сопротивлений двух других стадий. Тогда в зависимости от преобладающей роли того или иного сопротивления изменяется соотношение концентраций растворяемого вещества около поверхности растворения.
В 1886 г. А. Н. Щукарев сформулировал основной закон кинетики растворения: плотность потока вещества с поверхности растворения пропорциональна концентрационному недонасыщению раствора.
![]() (38.1)
(38.1)
где М – масса растворяемого вещества,
отводимого от поверхности растворения;
![]() – коэффициент массоотдачи; F
– поверхность растворения; (С*
– С) –разность концентраций
(движущая сила процесса растворения),
равная разности между концентрацией
вещества в состоянии насыщенного
раствора и действительной его концентрацией
в основной массе потока раствора.
– коэффициент массоотдачи; F
– поверхность растворения; (С*
– С) –разность концентраций
(движущая сила процесса растворения),
равная разности между концентрацией
вещества в состоянии насыщенного
раствора и действительной его концентрацией
в основной массе потока раствора.
Если лимитирующей является стадия диффузионного отвода вещества от поверхности растворения, а собственно процессы растворения и подвода растворителя не оказывают заметного влияния на общую скорость процесса, то концентрация вещества (целевого компонента) на поверхности практически будет равна концентрации насыщения С*. При этом скорость растворения определяется только интенсивностью наружной массоотдачи и обычно записывается в форме уравнения массоотдачи:
Когда лимитирующей стадией является сопротивление собственно процесса растворения, а подвод растворителя к поверхности и отвод растворившегося вещества не оказывают заметного влияния на общую скорость растворения, интенсивность процесса может быть записана как скорость химической реакции, зависящая от концентрации растворителя Ср в основной массе раствора:
![]() (38.2)
(38.2)
где п – порядок реакции растворения по концентрации Ср растворителя у поверхности растворения; k – константа скорости растворения.
Если лимитирующей стадией процесса является подвод растворителя к поверхности растворения, а собственно растворение вещества происходит без заметного сопротивления на поверхности, то концентрация растворителя на поверхности в таком случае становится практически равной нулю, движущая разность концентраций – равной Ср – 0 = Ср, а скорость растворения может быть записана в виде уравнения массоотдачи:
![]() (38.3)
(38.3)
где котором
![]() – коэффициент массоотдачи растворителя;
а – стехиометрический коэффициент
реакции растворения.
– коэффициент массоотдачи растворителя;
а – стехиометрический коэффициент
реакции растворения.
Характер изменения концентрации растворяемого вещества около поверхности растворения для общего случая, т. е. при одинаковом порядке диффузионных и кинетических сопротивлений процессу растворения, представлен на рис. 38.1. При этом концентрация растворяемого вещества на поверхности растворения Cгр оказывается меньше концентрации насыщения С*, а концентрация растворителя на поверхности Ср.гр – ниже его концентрации Ср в основном потоке жидкой фазы, но не равна нулю.
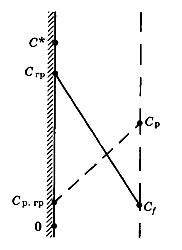
Рисунок 38.1 – Распределение концентраций растворяемого вещества и
растворителя (пунктир) у поверхности растворения.
Скорость процесса растворения, т. е. скорость переноса массы растворяющегося вещества через все три последовательные сопротивления процессу, устанавливается одинаковой для трех стадий процесса:
![]() =
=
![]() =
=
![]() (38.4)
(38.4)
Коэффициенты массоотдачи для растворителя
(
)
и растворяемого вещества (
)
неодинаковы по величине, как и движущие
разности концентраций процессов
массоотдачи (Ср – Ср.гр) и
(Сгр –C). При
всех прочих известных величинах из
системы трех уравнений (38.4) могут быть
найдены значения скорости растворения
![]() а также значения концентраций растворителя
Ср.гр и целевого
компонента Сгр на поверхности
(границе) растворения.
а также значения концентраций растворителя
Ср.гр и целевого
компонента Сгр на поверхности
(границе) растворения.
Скорость внешней (наружной) массоотдачи (т. е. величины и ) зависит в основном от гидродинамической обстановки вблизи поверхности растворения, от диффузионных свойств растворителя и растворяемого вещества.
