
- •Міністерство освіти і науки україни
- •1.1 Методичні вказівки до вивчення теоретичного матеріалу
- •1.2 Проведення дослідів
- •Лабораторна робота №2
- •Кислоти та їх залишки
- •1.2 Проведення дослідів
- •Лабораторна робота №3
- •1.2 Проведення дослідів
- •Лабораторна робота №4
- •Проведення дослідів
- •Лабораторна робота № 5
- •Проведення дослідів
- •Дослід 4. Визначення теплоти розчинення солі
- •Лабораторна робота №6
- •1.2 Проведення дослідів
- •Лабораторна робота №7
- •Розрахункові формули для визначення концентрації розчинів
- •1.2 Проведення дослідів
- •Лабораторна робота №8
- •1.1 Методичні вказівки до вивчення теоретичного матеріалу
- •1.2Проведення дослідів
- •Лабораторна робота №9
- •Проведення дослідів
- •Лабораторна робота №10
- •1.2 Проведення дослідів
- •Лабораторна робота №11
- •1.2 Проведення дослідів
- •Лабораторна робота №12
- •1.2 Проведення дослідів
- •Лабораторна робота №13
- •Проведення дослідів
- •Лабораторна робота №14
- •1.2 Проведення дослідів
- •Лабораторна робота №15
- •1.2 Проведення дослідів
- •Лабораторна робота №16
- •Література:
Лабораторна робота №4
-
Тема:
Хімічна рівновага.
Мета:
Визначити дослідним шляхом залежність хімічної рівноваги від різних чинників. Експериментально перевірити принцип Ле-Шательє.
Реактиви:
Розчини:
Ферум (ІІІ) хлорид;
Амоній роданід;
Тверді речовини:
Амоній хлорид.
Обладнання:
хімічний штатив з пробірками, піпетка, прилад з газами.
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Для закріплення знань про швидкість хімічної реакції та фактори, що впливають на неї, необхідно розглянути причини, які зумовлюють перебіг реакції в прямому і зворотньому напрямках (оборотність хімічної реакції), а також умови, при яких настає хімічна рівновага. Термодинамічною умовою хімічної рівноваги є рівняння ∆GP,T=0, тобто коли швидкості прямої та зворотньої реакції однакові.
Залежність між концентраціями речовин, які знаходяться в стані рівноваги, наприклад, для реакції в загальному вигляді
а A+bB
cC+dD
A+bB
cC+dD
вихідні речовини продукти реакції
визначається за законом дії мас за формулою:
Кхр=
[A]aР•[B]bР
[С]cР•[D]dР

тобто хімічна рівновага настає тоді, коли відношення добутку концентрацій продуктів реакцій до добутку концентрацій вихідних речовин дорівнює деякій сталій величині Кхр – константі хімічної рівноваги. Чим більше її значення, тим більший вихід продуктів реакції. Концентрації, які входять у вираз константи рівноваги, називають рівноважними і позначають [ ]Р.
Зверніть увагу, що у вираз константи рівноваги гетерогенної реакції, як і у вираз закону дії мас, входять лише концентрації рідких і газоподібних речовин. Чому?
Важливо також засвоїти, що хімічна рівновага є динамічною і може бути порушена зміною умов перебігу реакції. Перехід системи із одного стану рівноваги в інший називається зміщенням хімічної рівноваги.
Необхідно знати і вміти застосовувати закон дії мас та принцип Ле-Шательє.
Проведення дослідів
Дослід 1. Зміщення хімічної рівноваги при зміні концентрації і температури реагуючих речовин.
а) Налити в пробірку 3-5 мл FeCl3 і стільки ж розчину NH4SCN. Одержаний розчин перемішати і розділити на 4 пробірки. Першу залишити для порівняння, до другої додати 1 краплю концентрованого розчину FeCl3, в третю - кристалічний NH4SCN , в четверту - кристалічний NH4Cl . По зміні забарвлення розчину, обумовленого різною концентрацією ферум роданіда, зробити висновок про напрямок зміщення стану хімічної рівноваги. Сформулювати принцип Ле-Шательє. Записати рівняння реакції:
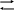 FeCl3
+ 3 NH4SCN
Fe (SCN)3
+ 3 NH4
Cl
FeCl3
+ 3 NH4SCN
Fe (SCN)3
+ 3 NH4
Cl
Вивести константу рівноваги для цього процесу.
б) В інтервалі температур від -11,2 до +140 градусів Цельсію молекули NO2 і N2O4 знаходяться в рівновазі між собою по рівнянню реакції :
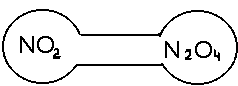
2 NO2 N2O4 + 58 кДж/моль
Для з’ясування впливу температури на перебіг цього процесу прилад із двома сполученими кульками заповнений сумішшю газів, розміщують таким чином, щоб одна кулька знаходилась у склянці з гарячою водою, друга - в склянці з холодною водою. Газ NO2 - бурого кольору, N2O4 - безбарвний. По зміні забарвлення газів у кульках зробити висновок про зміну концентрації NO2 таким чином, про зміщення положення рівноваги при зміненій температурі. Вивести константу рівноваги процесу димеризаціі двооксиду азоту.
Контрольні питання:
Який стан системи називають хімічною рівновагою?
Які чинники впливають на зміщення стану хімічної рівноваги?
Сформулюйте принцип Ле-Шательє.
Вивести константу хімічної рівноваги.
