
- •Биохимия (часть 1)
- •060101.65 – Лечебное дело
- •060103.65 – Педиатрия
- •060105.65 – Стоматология
- •СОдержАние
- •Предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •5) Положительно заряженные
- •1.4. Структурная организация белков
- •Методы определения n-концевой аминокислоты
- •Методы определения с-концевой аминокислоты
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Производные гемоглобина
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2.1. Влияние на ферменты активаторов и ингибиторов.
- •2.2. Химическая модификация фермента.
- •2.3. Аллостерическая регуляция.
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •D2 (эргокальциферол) d3 (холекальциферол)
- •3.2. Водорастворимые витамины
- •Методы определения витаминов
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •4.2. Транспорт веществ через мембрану
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Микросомальное окисление
- •6.6. Антиоксидантная система
- •6.7. Реакции общего пути катаболизма
- •6.7.1. Окислительное декарбоксилирование пвк
- •6.7.2. Цикл трикарбоновых кислот
- •Анаболические функции цикла Кребса
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •Литература
- •11. Харитонов, я.Ю. Аналитическая химия. Аналитика 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. / я.Ю. Харитонов. – м.: геотар-Медиа, 2014. – 656 с.
6.6. Антиоксидантная система
Активные формы кислорода (АФК) – соединения, в которых кислород имеет неспаренный электрон.
АФК образуются при изменении условий функционирования дыхательной цепи (например, при гипоксии), под действием УФ-лучей, при взаимодействии кислорода с ионами металлов переменной валентности (железом), в ходе спонтанного окисления некоторых веществ, при участии ферментов ксантиноксидазы или НАДФН-оксидазы. В этих условиях образуется супероксид-анион кислорода О2−, затем пероксид водорода Н2О2 и гидроксид-радикал НО.. Активные формы кислорода вызывают перекисное окисление липидов - процесс, ведущий к серьезному повреждению мембран, белков и ДНК.
Инактивация активных форм кислорода в клетках происходит под действием антиоксидантной системы.
Антиоксиданты - биологически активные вещества, взаимодействующие со свободными радикалами и препятствующие процессам свободнорадикального окисления органических веществ в организме.
В антиоксидантную систему входят несколько ферментов и низкомолекулярные антиоксиданты (витамины, пептиды).
Супероксиддисмутаза (СОД) превращает супероксид-анион кислорода в пероксид водорода Н2О2:
2O2- + 2Н+ H2O2 + O2.
Каталаза - геминовый фермент, содержащий Fe3+, катализирует реакцию разложения пероксида водорода. При этом образуются вода и кислород:
2H2O2 O2 + 2H2О.
Наибольшая активность каталазы в организме характерна для печени. Каталазы много в эритроцитах, где она защищает гем гемоглобина от окисления.
Пероксидаза - геминовый фермент, восстанавливает пероксид водорода до воды; при этом идет окисление другого вещества:
2H2O2 + R 2H2О + RO2.
Пероксидаза способна разлагать и другие перекиси, превращая их в спирты. Пероксидазная активность обнаруживается в печени, почках, нейтрофильных лейкоцитах.
Витамины, проявляющие антиоксидантные свойства – С, Е, А, Р. Антиоксидантные свойства проявляют трипептид глутатион, таурин (2-аминоэтансульфоновая кислота), дипептид карнозин. Так, способность глутатиона участвовать в окислительно-восстановительных реакциях связана с наличием групп -SН:
2ГSН + RООН ГSSГ + RОН + Н2О.
Полное подавление перекисных процессов в тканях, по-видимому, нецелесообразно. Свободные радикалы индуцируют апоптоз, участвуют в формировании клеточного иммунитета, стимулируют работу фосфолипаз, участвуя, тем самым, в синтезе эйкозаноидов.
Однако усиленная генерация свободных радикалов сопровождает патологические состояния (болезнь Паркинсона, Альцгеймера) и сам процесс биологического старения.
6.7. Реакции общего пути катаболизма
6.7.1. Окислительное декарбоксилирование пвк
Окислительное декарбоксилирование пировиноградной кислоты - многостадийный процесс, который катализирует пируватдегидрогеназный комплекс - митохондриальный мультиферментный комплекс, соединенный с внутренней мембраной со стороны матрикса. ПВК поступает к комплексу из матрикса, и туда же освобождаются продукты реакции.
Пируватдегидрогеназный комплекс включает три фермента (пируватдегидрогеназа (Е1), ацетилтрансфераза (Е2), дегидрогеназа дигидролипоевой кислоты (Е3)) и пять коферментов (НАД+, ФАД, тиаминпирофосфат, липоевая кислота, кофермент А (рис. 36)).
Тиаминпирофосфат связан с пируватдегидрогеназой (Е1), липоевая кислота - с ацетилтрансферазой (Е2), ФАД - с дегидрогеназой дигидролипоевой кислоты (Е3). Кофермент А и НАД+ находятся в свободно растворенном состоянии.
В состав пируватдегидрогеназного комплекса входит примерно по три десятка молекул Е1 и Е2 и 10 молекул Е3. Комплекс работает как конвейер: промежуточные продукты не освобождаются в раствор, а передаются от фермента к ферменту.
а |
б |
Рис. 36. Структура кофермента А (а) и липоевой кислоты (б) |
|
Первую реакцию (рис. 37) катализирует Е1, субстратами являются ПВК и дегидролипоевая кислота, являющаяся простетической группой Е2. От ПВК отщепляется карбоксильная группа и образуется СО2, а ацетильный остаток соединяется с атомом серы липоевой кислоты в составе ацетилтрансферазы. Образуется ацетиллипоат-Е2.
Во второй реакции ацетилтрансфераза (Е2) катализирует перенос ацетильного остатка, соединенного с его простетической группой, на коэнзим А. Продукты этой реакции - дигидролипоевая кислота в составе Е2 и ацетил-KоА.
В третьей реакции происходит дегидрирование дигидролипоевой кислоты в составе ацетилтрансферазы при воздействии фермента Е3 (дегидрогеназа дигидролипоевой кислоты), содержащего ФАД. ФАД передает водород на НАД+. Образуются НАДН+Н+ и дегидролипоевая кислота в составе Е2. Последний фермент снова вступает в окислительное декарбоксилирование ПВК.
Ацетил-KоА (продукт второй реакции) затем окисляется в цикле Кребса. Водород с НАДН (продукт третьей реакции) поступает в дыхательную цепь, где образуется АТФ.
Энергетический выход окислительного декарбоксилирования пирувата – 3 АТФ.
Суммарное уравнение процесса:
СH3CОCOOH + HSKoA + НАД+ СH3CОSKoA + НАДН + Н+ + СО2.
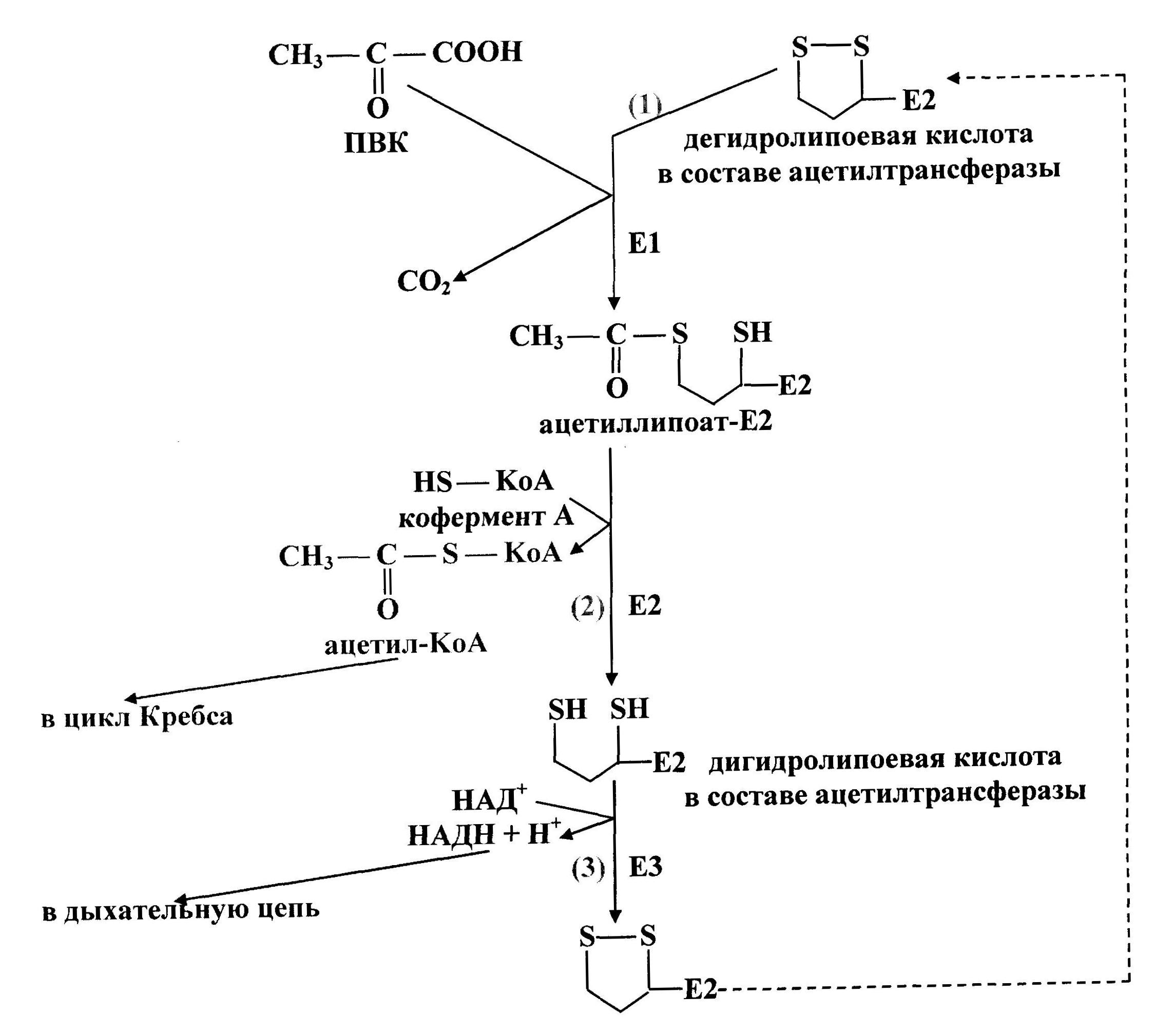
Рис. 37. Схема окислительного декарбоксилирования пирувата
По механизму «обратной связи» работу пируватдегидрогеназного комплекса ингибируют конечные продукты окислительного декарбоксилирования - ацетил-KоА, НАДН+Н+, а также АТФ. Увеличивают активность комплекса пировиноградная кислота и АДФ.
Также имеет место гормональная регуляция: инсулин увеличивает активность пируатдегидрогеназного комплекса, глюкагон - снижает.


