
- •Содержание
- •Введение
- •Основные химические понятия
- •Основные химические законы.
- •Строение атома
- •Свойства элементарных частиц, образующих атом
- •Изотопы: а) разновидности атомов, имеющих одинаковый заряд ядра, но различную массу;
- •Строение электронных оболочек атома
- •Электронные формулы ионизированных атомов
- •Возбужденное состояние атома
- •Периодический закон, периодическая система д.И.Менделеева
- •3 Малых 4 ,больших
- •Главные подгруппы побочные подгруппы
- •Химическая связь и строение молекул
- •Основные свойства химической связи
- •Основные типы химической связи
- •Ковалентная связь
- •II. Донорно-акцепторная связь (по ковалентному типу)
- •III. Ионная связь
- •IV. Металлическая связь
- •V. Водородная связь
- •V1. Силы Ван-дер-Ваальса (Межмолекулярные взаимодействия)
- •Метод молекулярных орбиталей (мо)
- •Основные классы неорганических соединений
- •Химические свойства
- •Химические свойства
- •Получение
- •Химические свойства
- •Получение
- •Химические свойства
- •Получение
- •Номенклатурные правила для кислот и кислотных остатков
- •Комплексные соединения
- •Основные положения теории Вернера:
- •Строение комплексных соединений
- •Классификация комплексных соединений
- •Реакции комплексообразования
- •Химические свойства
- •Окислительно-восстановительные реакции
- •Номенклатура комплексных соединений
- •Природа сил комплексообразования
- •Метод валентных связей
- •Теория кристаллического поля
- •Цвет комплекса
- •Применение комплексных соединений в медицине и фармации
- •Окислительно-восстановительные реакции
- •Типы окислительно-востановительных реакций
- •Уравнение Нернста
- •Некоторые понятия энергетики химических реакций
- •Основы химической кинетики
- •Классификация реакций по механизмам
- •1.По количеству частиц, участвующих в реакции (молекулярность или порядок реакции).
- •Скорость химических реакций
- •I. Зависимость скорости реакции от природы реагирующих веществ
- •II. Зависимость скорости реакции от концентраций реагирующих веществ
- •III. Влияние температуры на скорость реакции
- •IV. Влияние катализатора на скорость реакции
- •V. Влияние давления на скорость газовых реакций
- •VI. Влияние степени измельчённости твердых веществ на скорость реакции
- •Химическое равновесие
- •Учение о растворах
- •Различия между раствором и простой механической смесью:
- •Классификация растворов
- •4. По количеству растворенных частиц:
- •Растворимость газов
- •Растворимость жидких и твёрдых веществ
- •Электролитическая диссоциация
- •Характер диссоциации
- •Константа равновесия
- •Произведение растворимости (пр)
- •Растворимость (р)
- •Связь между р и пр
- •Диссоциация воды. Водородный показатель (рН)
- •Закон разбавления Оствальда
- •Ионные уравнения. Амфотерность. Гидролиз солей Ионные уравнения
- •Амфотерность соединений
- •Гидролиз солей
- •Коллигативные свойства растворов
- •Осмос, осмотическое давление
- •Изотонический коэффициент (I)
- •Понижение давления насыщенных паров растворителя
- •Теории кислот и оснований
- •Природа воды
- •Электролитическая диссоциация гидроксидов; амфотерность
- •Химия элементов общие свойства металлов
- •Общие свойства неметаллов
- •Основные свойства s-элементов
- •Физические свойства
- •Получение водорода
- •Химические свойства
- •Гидриды
- •Химические свойства
- •Физические свойства
- •Получение водородпероксида
- •Химические свойства
- •Основные свойства s- металлов.
- •Основные свойства d- элементов
- •Основные свойства р-элементов
- •Элементы 3-а группы
- •Элементы 4-а группы
- •Элементы 5-а группы
- •РаспространЕнность химических элементов в природе и их биогенность
- •Биогенная характеристика органогенов и макроэлементов.
- •Наиболее токсичные для организма человека элементы.
- •Литература
- •Ряд активности металлов (электрохимический ряд напряжений)
- •Стандартные окислительно-восстановительные потенциалы
- •Растворимость кислот, солей и оснований в воде
- •Произведения растворимости некоторых труднорастворимых электролитов (25с)
- •Лекции по общей и неорганической химии
4. По количеству растворенных частиц:
насыщенные (устойчивы - имеет место равновесие между раствором и твердым веществом); ∆G = 0.
б)ненасыщенные; ∆G < 0.
в)пересыщенные. ∆G > 0; система неустойчива, при встряхивании из них образуются насыщенные растворы и выделяется избыток растворённого вещества.
Растворимость газов
Этот процесс можно рассматривать:
1) либо как механический процесс (действие сил Ван-дер-Ваальса) – например при растворении в воде Н2 , О2 , N 2 , инертных газов;
2)либо как химическое взаимодействие
(NH3 + H2O = NH4OH ; Cl2 + H2O = HCl + HClO).
Растворимость газов зависит от нескольких факторов:
От давления по закону Генри – масса газа, растворяющегося в данном объёме жидкости при постоянной температуре, прямо пропорциональна его парциальному давлению:
mгаза = k P,
где m – масса газа в растворе;
k – константа пропорциональности;
Р – парциальное давление.
От температуры – чем выше температура, тем хуже растворяется газ.
От наличия в растворе других веществ по закону И.М. Сеченова (был выведен при подсчёте кислородной ёмкости крови) – на растворимость газов в жидкости влияют другие вещества:
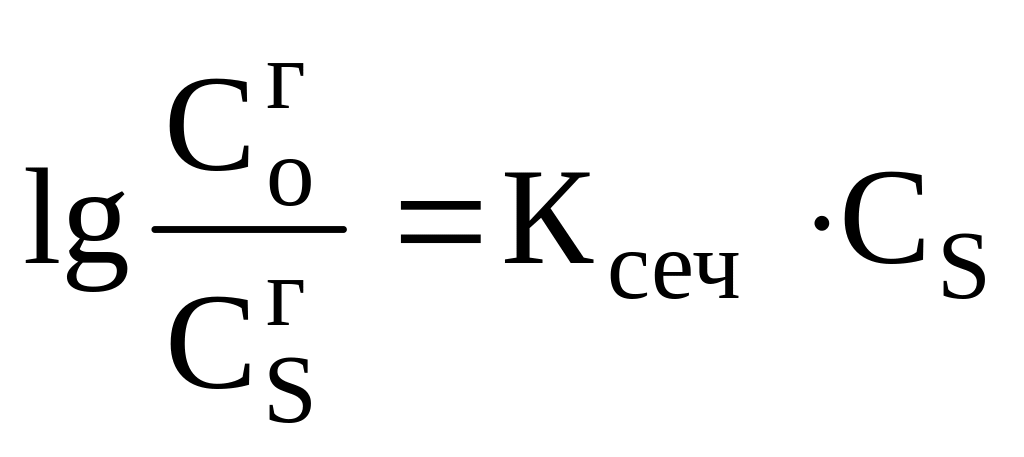 ,
,
где
![]() -
растворимость газа в чистом растворителе;
-
растворимость газа в чистом растворителе;
![]() -
растворимость газа в растворе соли;
-
растворимость газа в растворе соли;
![]() - концентрация
соли в растворе;
- концентрация
соли в растворе;
![]() -
константа Сеченова, положительная
величина.
-
константа Сеченова, положительная
величина.
Анализ
формулы показывает, что всегда
![]() .
.
Растворимость жидких и твёрдых веществ
Как правило не зависит от давления, потому что при смешивании жидкостей объем меняется незначительно и может измениться только при давлении в несколько тысяч атмосфер;
Как правило это эндотермический процесс: при повышении температуры растворимость возрастает, так как энергия затрачивается на разрушение кристаллической решетки и равномерное распределение молекул (ионов) по всему объему раствора.
Если же при растворении выделяется теплота, то следовательно в растворе образуются сольватные частицы (если растворитель – вода, то чакстицы называют гидратными) и процесс будет экзотермическим.
Электролитическая диссоциация
Электролиты – вещества, расплавы и растворы которых содержат подвижные ионы и проводят электрический ток.
Электролитическая диссоциация - процесс распада электролитов на ионы под действием растворителя (происходит вследствие электростатического взаимодействия вещества с полярными молекулами растворителя).
Теорию создал С. Аррениус, и он рассматривал диссоциацию как механический распад; ввел понятия «катион» и «анион».
Дополнил теорию И.А. Каблуков, доказав, что диссоциация - физико-химический процесс. Полярные молекулы растворителя способствуют лучшей диссоциации, т. к. окружают ионы в растворе, образуя довольно устойчивые частицы: «сольваты». Если растворитель - Н2О, то частицы называются «гидраты», и иногда при испарении растворов эти захваченные молекулы воды остаются в кристаллической решетке.
Степень диссоциации () - количественная мера способности вещества распадаться на ионы (экспериментально ее можно определить, например, исследуя электропроводность растворов):
![]() ,
,
зависит от:
природы растворителя (чем он полярнее, тем больше);
б)температуры (чем больше температура, тем больше);
в)концентрации (чем меньше С, тем больше );
г)от природы растворенных веществ.
По величине все вещества можно поделить на 3 группы.
1. Сильные электролиты ( > 30%):
a) минеральные кислоты НС1, HBr, HI, HNO3, H2SO4, HCNS, HC1O4, HMnO4;
б) основания, образованные щелочными и щелочно-земельными металлами:
![]()
в)соли, помеченные в таблице растворимости буквой «р».
2. Слабые электролиты ( < 1-3%):
почти все органические кислоты;
б)минеральные кислоты H2S, Н2СОз, H2SiO3, HCN, Н2F2 ;
в)основания, образованные остальными металлами; NH4OH;
г)соли, помеченные в таблице растворимости буквами «м» и «н»;
д)Н2О
3. Средние электролиты (1 - 3% < < 30%):
НСООН, HNO2, H2SO3, H3PO4, Mg(OH)2 и т. д.
