
- •Содержание
- •Введение
- •Основные химические понятия
- •Основные химические законы.
- •Строение атома
- •Свойства элементарных частиц, образующих атом
- •Изотопы: а) разновидности атомов, имеющих одинаковый заряд ядра, но различную массу;
- •Строение электронных оболочек атома
- •Электронные формулы ионизированных атомов
- •Возбужденное состояние атома
- •Периодический закон, периодическая система д.И.Менделеева
- •3 Малых 4 ,больших
- •Главные подгруппы побочные подгруппы
- •Химическая связь и строение молекул
- •Основные свойства химической связи
- •Основные типы химической связи
- •Ковалентная связь
- •II. Донорно-акцепторная связь (по ковалентному типу)
- •III. Ионная связь
- •IV. Металлическая связь
- •V. Водородная связь
- •V1. Силы Ван-дер-Ваальса (Межмолекулярные взаимодействия)
- •Метод молекулярных орбиталей (мо)
- •Основные классы неорганических соединений
- •Химические свойства
- •Химические свойства
- •Получение
- •Химические свойства
- •Получение
- •Химические свойства
- •Получение
- •Номенклатурные правила для кислот и кислотных остатков
- •Комплексные соединения
- •Основные положения теории Вернера:
- •Строение комплексных соединений
- •Классификация комплексных соединений
- •Реакции комплексообразования
- •Химические свойства
- •Окислительно-восстановительные реакции
- •Номенклатура комплексных соединений
- •Природа сил комплексообразования
- •Метод валентных связей
- •Теория кристаллического поля
- •Цвет комплекса
- •Применение комплексных соединений в медицине и фармации
- •Окислительно-восстановительные реакции
- •Типы окислительно-востановительных реакций
- •Уравнение Нернста
- •Некоторые понятия энергетики химических реакций
- •Основы химической кинетики
- •Классификация реакций по механизмам
- •1.По количеству частиц, участвующих в реакции (молекулярность или порядок реакции).
- •Скорость химических реакций
- •I. Зависимость скорости реакции от природы реагирующих веществ
- •II. Зависимость скорости реакции от концентраций реагирующих веществ
- •III. Влияние температуры на скорость реакции
- •IV. Влияние катализатора на скорость реакции
- •V. Влияние давления на скорость газовых реакций
- •VI. Влияние степени измельчённости твердых веществ на скорость реакции
- •Химическое равновесие
- •Учение о растворах
- •Различия между раствором и простой механической смесью:
- •Классификация растворов
- •4. По количеству растворенных частиц:
- •Растворимость газов
- •Растворимость жидких и твёрдых веществ
- •Электролитическая диссоциация
- •Характер диссоциации
- •Константа равновесия
- •Произведение растворимости (пр)
- •Растворимость (р)
- •Связь между р и пр
- •Диссоциация воды. Водородный показатель (рН)
- •Закон разбавления Оствальда
- •Ионные уравнения. Амфотерность. Гидролиз солей Ионные уравнения
- •Амфотерность соединений
- •Гидролиз солей
- •Коллигативные свойства растворов
- •Осмос, осмотическое давление
- •Изотонический коэффициент (I)
- •Понижение давления насыщенных паров растворителя
- •Теории кислот и оснований
- •Природа воды
- •Электролитическая диссоциация гидроксидов; амфотерность
- •Химия элементов общие свойства металлов
- •Общие свойства неметаллов
- •Основные свойства s-элементов
- •Физические свойства
- •Получение водорода
- •Химические свойства
- •Гидриды
- •Химические свойства
- •Физические свойства
- •Получение водородпероксида
- •Химические свойства
- •Основные свойства s- металлов.
- •Основные свойства d- элементов
- •Основные свойства р-элементов
- •Элементы 3-а группы
- •Элементы 4-а группы
- •Элементы 5-а группы
- •РаспространЕнность химических элементов в природе и их биогенность
- •Биогенная характеристика органогенов и макроэлементов.
- •Наиболее токсичные для организма человека элементы.
- •Литература
- •Ряд активности металлов (электрохимический ряд напряжений)
- •Стандартные окислительно-восстановительные потенциалы
- •Растворимость кислот, солей и оснований в воде
- •Произведения растворимости некоторых труднорастворимых электролитов (25с)
- •Лекции по общей и неорганической химии
Классификация комплексных соединений
По природе лигандов и центрального иона:
а)
неорганические -
![]() ;
;
б)
органические -
![]() ;
;
в)
смешанные -
![]() .
.
По заряду комплексного иона:
а)
катионные -
![]() ;
;
б)
анионные -
![]() ;
;
в)
нейтральные -
![]() .
.
По аналогии с основными классами соединений:
а)
комплексные кислоты -
![]() ;
;
б)
основания -
![]() ;
;
в) соли - .
По природе лиганда:
а)
гидроксокомплексы -
![]() ;
;
б)
аквакомплексы -
![]() ;
;
в)
аммиакаты -![]() ;
;
г)
ацидокомплексы (лигандами являются
остатки кислот) -
![]() ,
,
![]() .
.
По внутренней структуре комплексных соединений:
а)
моноядерные -
![]() ;
;
б)
полиядерные -
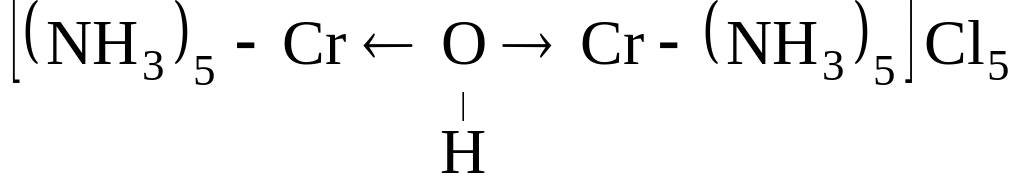
Реакции комплексообразования
Соли взаимодействуют с нейтральными молекулами
а)
![]() ;
;
б)
![]() .
.
Из двух простых солей; центральным ионом является менее активный металл
![]() .
.
Реакции обмена между простой и комплексной солью
![]() .
.
Химические свойства
Обменные реакции
![]() .
.
Реакции замещения одних лигандов на другие
![]() .
.
Окислительно-восстановительные реакции
![]()
окислитель восстановитель
![]() ,
,
![]() .
.
Диссоциация комплексных соединений может идти по нескольким ступеням; константы равновесия для каждой ступени считают по закону действующих масс.
I ступень – диссоциация молекулы, например
![]()
 .
.
II ступень – распад комплексного иона. Этот процесс может идти поэтапно, когда лиганды отделяются по одному.
Краткая запись:
![]() ,
,
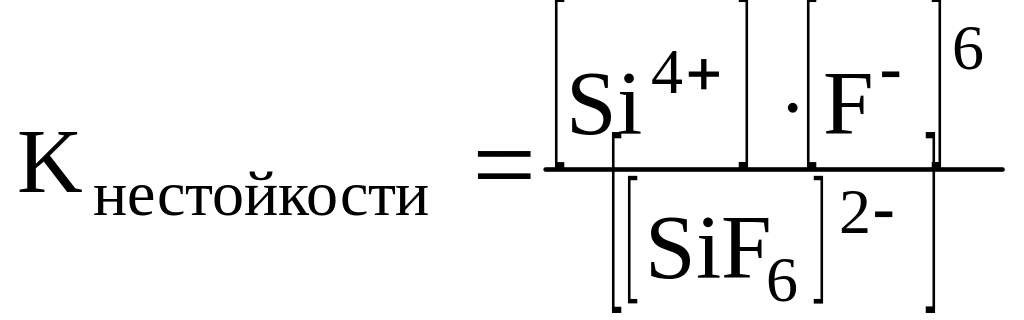 .
.
Кнестойкости характеризует устойчивость комплексного иона при растворении: чем больше константа нестойкости, тем менее устойчив комплексный ион.
Иногда используют обратную величину:
 .
.
Номенклатура комплексных соединений
Молекулу называют слева направо в именительном падеже.
При названии комплексного иона вначале называют лиганды, а затем центральный ион.
Лиганды (если они разные) называют в алфавитном порядке с использованием греческих приставок (ди-, три-, тетра-, …).
а) Если лиганд – нейтральная молекула, то его называют без окончания
(H2O – «аква», NH3 – «аммин», СО – «карбонил», NO – «нитрозо»).
б) Если лиганд заряжен, то используют окончание «о»
(F - - «фторо», ОН - - «гидроксо», …).
При назывании центрального атома применяют: а)русское название элемента, если комплекс катионный; б) греческое или латинское название, если комплекс анионный.
При назывании по Штоку после названия центрального атома указывают его валентность, а в названии по Эвенсу-Бассету указывают заряд комплексного иона.
Пример:
![]() по Штоку: железо
(II)
гексацианоферрат (III);
по Штоку: железо
(II)
гексацианоферрат (III);
по Эвенсу-Бассету: железо (+2) гексацианоферрат (3-).
Природа сил комплексообразования
Метод валентных связей
За счёт свободных d – орбиталей центральный ион, как правило, будет акцептором электронных пар, а лиганды являются донорами. Орбитали центрального атома гибридизуются, причём на тип гибридизации влияет число лигандов и их электронная структура. Характер гибридизации определяет структуру комплексного иона.
![]()
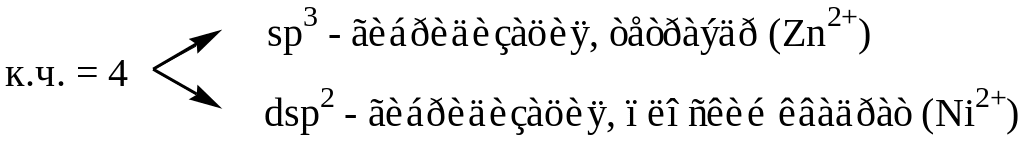
![]()
Иногда прочность связи усиливается благодаря появлению дативных связей (обратны донорно-акцепторным).
Пример:
Комплексное
соединение содержит центральный ион
![]() и лиганды
и лиганды
![]() ;
;
![]() :
:
![]()
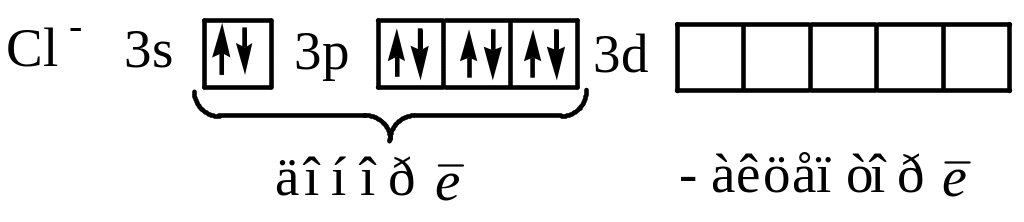
Таким
образом, между
![]() и
и
![]() действуют связи:
действуют связи:
а) донорно-акцепторные;
б) дативные;
в) электростатические.
