
- •Лекція №4 Тема: Організація постачання аптечних закладів.
- •2. Вимоги до приміщень для зберігання наркотичних і психотропних речовин та прекурсорів
- •3.Особливості зберігання отруйних, сильнодіючих та інших лз
- •6. Системи продаж лікарських засобів.
- •12.Особливості зберігання наркотичних і психотропних речовин та прекурсорів
- •13.Особливості зберігання отруйних і сильнодіючих речовин
Лекція №4 Тема: Організація постачання аптечних закладів.
Мета: оволодіти основними напрямками системи постачання аптек в умовах формування фармацевтичного ринку в Україні.
Знати :
характеристику типової організаційної структури суб’єктів господарювання, які здійснюють оптову реалізацію ліків;
систему продаж лікарських засобів;
організаційні вимоги до суб’єкта господарювання, який провадить діяльність з оптової торгівлі ЛЗ;
завдання та функції аптечних складів;
вимоги до приміщень аптечних складів;
функції основних відділів аптечних складів;
обов’язки уповноваженої особи аптечного складу;
методику вхідного контролю якості ЛЗ;
Вміти:
розв’язувати ситуаційні завдання стосовно запитань даної теми.
План:
1.Характеристика типової організаційної структури суб’єктів господарювання, які здійснюють оптову реалізацію ліків.
2.Системи продаж лікарських засобів.
3.Організаційні вимоги до суб’єктів господарювання, який провадить діяльність з оптової торгівлі лікарськими засобами.
4.Завдання та функції аптечних складів(баз).
5.Вимоги до приміщень аптечних складів.
6.Функції основних відділів (секторів) аптечних складів(баз)
7. Особливості зберігання наркотичних і психотропних речовин та прекурсорів
8.Особливості зберігання отруйних і сильнодіючих речовин
9.Поводження із зіпсованими фармацевтичними товарами.(ПСРС)
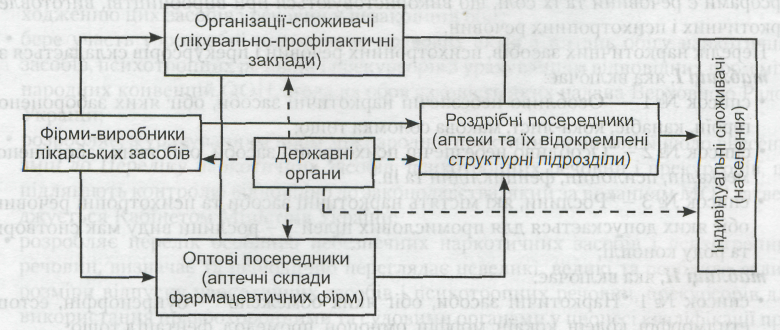
Суб'єкти системи лікарського забезпечення
Система лікарського забезпечення - це контрольована державою сукупність взаємопов'язаних підприємств, що здійснюють виробництво і доведення лікарських засобів до споживачів (рис. 1.3).
 Рис
1.3
Рис
1.3
В Україні на початок 2008 р. суб'єктами системи лікарського забезпечення були 429 зарубіжних (через представництва та фірми-імпортери) і 143 вітчизняних фармацевтичних виробників, 789 аптечних складів (баз), 11 177 аптек різних форм власності та їх відокремлені структурні підрозділи - 5 399 аптечних пунктів і 5 853 аптечних кіосків, а також індивідуальні споживачі (потенційно - усе населення) та організації-споживачі (6 922 лікувально-профілактичних заклади різного рівня акредитації та інші організації й установи).
Поняття про виробництво ліків і належну виробничу практику
Виробництво лікарських засобів являє собою діяльність, пов'язану з серійним випуском лікарських засобів, яка включає всі або хоча б одну зі стадій технологічного процесу, в т. ч. процеси фасування, пакування і маркування, контроль якості у процесі виробництва, контроль якості готової продукції, а також реалізацію продукції власного виробництва.
У системі забезпечення якості лікарських засобів серійного випуску важлива роль відводиться належній виробничій практиці НВП. Вона являє собою сукупність правил з організації виробництва і контролю якості, яка є елементом системи забезпечення якості, що забезпечує стабільне виробництво лікарських засобів відповідно до вимог технологічної нормативної документації (ТНД) та проведення контролю якості згідно з аналітичною нормативною документацією (АНД). Правила встановлюють вимоги:
• до якості всього процесу виробництва та контролю якості готової продукції зокрема;
• системи документації, яку повинен розробити виробник для забезпечення якості здійснення усіх керованих етапів виробництва лікарських засобів;
• до ресурсів, наявність яких необхідна виробнику для успішного впровадження НВП лікарських засобів, постійного підтримання та підвищення досягнутого рівня якості, до яких відносяться: персонал, приміщення, обладнання, вихідна сировина та матеріали;
• безпосередньо до технологічного процесу, випуску продукції, виробництва за контрактом, особливостей організації виробництва стерильних та біологічних (імунологічних) лікарських засобів, газів медичних, лікарських засобів із лікарської рослинної сировини, досліджуваних лікарських засобів;
• до внутрішнього аудиту (самоінспекції) для оцінки відповідності діючої системи якості вимогам НВП;
• системи управління недоброякісною продукцією, зокрема до роботи з рекламаціями, вилученням з обігу такої продукції, виконанням коригувальних та запобіжних дій для усунення причин та запобігання повторення недоброякісності продукції у майбутньому.
Варто зазначити, що сукупність зазначених правил є дещо специфічною для ЄС, США та країн Азії та Африки. Тому виробникам лікарських засобів при експортуванні власної продукції варто враховувати ті правила, що характерні для конкретного ринку збуту.
Характеристика підприємств-виробників лікарських засобів
Національний ринок розробляє понад 570 вітчизняних і зарубіжних фармацевтичних виробників, які класифікуються за:
• рівнем інтеграції у світову економіку (національні, транснаціональні);
• рівнем економічного розвитку країни-засновника (ринкова економіка, перехідна економіка, економіка, що розвивається);
• власністю (колективні, приватні, державні);
• обсягом виробництва (великі, середні, малі);
• значенням українського ринку у збутовій діяльності (основний, додатковий, резервний);
• патентним захистом продукції (виробники оригінальних ліків та/або генериків);
• характером груп пропонованих ліків (однієї чи багатьох груп за анатомо-терапев-тично-хімічною класифікацією);
• стратегією просування (одночасно весь товарний асортимент або найперспектив-ніші торгові марки);
• каналами просування (представництво, спільне підприємство, внутрішні оптові фармацевтичні фірми);
• рекламною стратегією (агресивна, інтенсивна, поміркована, непомітна).
У діяльності іноземних фармацевтичних фірм пріоритетом є території, потім обсяги продажів, а у вітчизняних - навпаки.
Для транснаціональних компаній освоєння відносно невеликого за обсягом українського ринку поки що не є пріоритетом їх діяльності. Вони не отримують великого доходу від реалізації лікарських засобів у нашій країні, на відміну від діяльності па ринках розвинутих держав. Для прикладу, товарообіг компанії "Фармація корпорейшн" на території Франції, яка за площею й чисельністю населення схожа з Україною, щорічно перевищує 200 мли дол. США, тобто майже рівний шостій частині імпорту лікарських засобів в Україну за рік. Більшість транснаціональних компаній працюють на нашому ринку з огляду на перспективу, оскільки аналіз позитивних тенденцій в економіці країни дозволяє сподіватись на певні перспективи майбутньої діяльності. На даному етапі розвитку українського ринку мета транснаціональних компаній - дати можливість вітчизняним лікарям та пацієнтам ознайомитися з їх лікарськими засобами. При цьому проводиться зважена цінова політика, пристосована до умов нашого ринку. Проте адаптувати ціни досить складно, оскільки якісні препарати не можуть коштувати дешево.
Таким чином, основними принципами діяльності більшості транснаціональних компаній стосовно України є дослідження ринку, визначення конкурентоспроможності своїх ліків і побудова збутової мережі.
Для фармацевтичних фірм із колишніх соцкраїн український ринок відіграє велике значення. Вони мають найвищі показники його освоєння, оскільки традиційно поставляють лікарські засоби ще з часів колишнього Союзу. Проте, не дивлячись на великий обсяг продаж, ці фірми у той же час не відчувають абсолютної залежності від нашого ринку, маючи всі можливості для експериментів у сфері організації дистрибуції та пропонуванні нової ідеології товаропросування.
Стосовно фармацевтичних фірм з країн СНД і Прибалтики, то сучасний стан взаємовідносин характеризується загостренням конкурентної боротьби з боку російських фармацевтичних виробників, позаяк ціни на їх лікарські засоби, як правило, нижчі від цін на українські аналоги. Щодо виробників з Азії та Сходу, то вітчизняна промисловість теж поки що не може конкурувати з ними ані за вкладенням у рекламні заходи, ані за цінами.
Найбільше ліків в Україну поставляють Німеччина, Індія, Франція, Словенія та Угорщина, а серед підприємств - італійська корпорація Менаріні Груп, французька -Санофі-Авентіс Груп, швейцарська - Новартіс Груп, французька - Серв'є Груп, великобританська - ГлаксоСмітКляйн, словенська компанія КРКА, угорський хімічний завод Гедеон Ріхтер.
Щодо вітчизняних виробників, то станом на 1 січня 2008 року в Україні налічувалося 143 підприємства, серед них 39 виробляли фітопрепарати, 7 - ліки виключно з форми іn balk*, 13 - субстанції, 16 - медичний кисень і 68 - основні лікарські засоби. Тобто власне готові лікарські засоби в Україні виробляло 81 фармацевтичних підприємств, або 56,6 % від суб'єктів господарювання, яким видано ліцензію на виробництво лікарських засобів.
Базовими підприємствами-виробниками є корпорація "Артеріум" (ВАТ "Київмед-препарат"+ВАТ Таличфарм"), ЗАТ "ФФ "Дарниця", ВАТ "Фармак", ЗАТ "НЦП "Бор-щагівський ХФЗ", ТзОВ "Фармацевтична компанія "Здоров'я", ЗАТ "Біофарма", ЗАТ "Київський вітамінний завод", ТзОВ "Юрія-фарм", ВАТ "Інтерхім". Вони не тільки продукують близько двох третин загального обсягу лікарських засобів, але й стали основними замовниками інноваційної та науково-технічної продукції.
Суб'єкт господарювання, який має намір провадити господарську діяльність з виробництва лікарських засобів, відповідно до Закону України "Про ліцензування певних видів господарської діяльності" від 01.06. 2000 р. № 1775-ІП (із змінами) та Постанови КМ України від 04.06. 2001 р. № 756 (із змінами) "Про затвердження переліку документів, які додаються до заяви про видачу ліцензії для окремого виду господарської діяльності", особисто або через уповноважений ним орган чи особу звертається до Держлікін-спекції (органу ліцензування) із заявою встановленого зразка про видачу ліцензії.
У разі наявності у заявника структурних підрозділів, які провадитимуть господарську діяльність на підставі отриманої ліцензії, у заяві зазначається їх місцезнаходження.
До заяви про видачу ліцензії додається:
• копія свідоцтва про державну реєстрацію суб'єкта підприємницької діяльності або копія довідки про внесення до Єдиного державного реєстру підприємств та організацій України, засвідчена нотаріально або органом, який видав оригінал документа;
• відомості за підписом керівника суб'єкта господарювання про наявність та відповідність його матеріально-технічної бази, кваліфікації працівників Ліцензійним умовам провадження господарської діяльності за формою, встановленою МОЗ України, або засвідчені суб'єктом господарювання сертифікати належної виробничої практики на всі виробничі дільниці, видані у порядку, встановленому МОЗ України.
Вид діяльності, що підлягає ліцензуванню, повинен бути зазначений в установчих документах суб'єкта господарювання. Виробники лікарських засобів провадять реалізацію продукції власного виробництва на підставі ліцензії на виробництво лікарських засобів.
Поняття про оптову торгівлю ліків та належну практику дистрибуції.
Оптова торгівля (реалізація) лікарськими засобами--діяльність з придбання лікарських засобів або інших суб’єктів господарювання, що мають відповідну ліцензію, зберігання та продажу лікарських засобів з аптечних складів(баз) іншим суб’єктам оптової або роздрібної торгівлі лікарськими засобами, які мають
відповідні ліцензії, та безпосередньо лікувально-профілактичним закладам і виробникам лікарських засобів.
Суб'єкт господарювання, який має намір провадити господарську діяльність з оптової торгівлі лікарських засобів, відповідно до Закону України "Про ліцензування певних видів господарської діяльності" від 01.06. 2000 р. № 1775-ІП (із змінами) та Постанови КМ України від 04.06. 2001 р. № 756 (із змінами) "Про затвердження переліку документів, які додаються до заяви про видачу ліцензії для окремого виду господарської діяльності", особисто або через уповноважений ним орган чи особу звертається до Держлікінспекції (органу ліцензування) із заявою встановленого зразка про видачу ліцензії.
У разі наявності у заявника структурних підрозділів, які провадитимуть господарську діяльність на підставі отриманої ліцензії, у заяві зазначається їх місцезнаходження.
До заяви про видачу ліцензії додається:
копія свідоцтва про державну реєстрацію суб'єкта підприємницької діяльності або копія довідки про внесення до Єдиного державного реєстру підприємств та організацій України, засвідчена нотаріально або органом, який видав оригінал документа:
засвідчена в установленому порядку копія паспорта аптечного закладу (структурного підрозділу), складеного за формою, затвердженою Кабінетом Міністрів України.
Вид діяльності, що підлягає ліцензуванню, повинен бути зазначений в установчих документах суб'єкта господарювання.
Оптова реалізація лікарських засобів здійснюється через організаційно-функціональні структури суб'єктів господарювання (виробничих та оптових фармацевтичних фірм) - аптечні склади (бази). Вони належать до закладів охорони здоров'я та функціонують з дозволу і під контролем державних органів. При цьому Ліцензіат повинен забезпечити:
закупівлю та реалізацію лише лікарських засобів, які зареєстровані згідно із законодавством України, а також супутніх товарів за переліком, що визначається МОЗ України;
дотримання визначених виробником лікарських засобів загальних та специфічних умов зберігання на всіх етапах технологічного процесу (в т.ч. під час транспортування) та схоронність лікарських засобів;
уникнення при зберіганні лікарських засобів їх ушкоджень (розливання, розсипання, розбиття), зараження мікроорганізмами і перехресної контамінації;
функціонування системи виявлення будь-якої продукції, що не відповідає встановленим вимогам (технологічної документації, аналітично-нормативної документації, діючих стандартів якості), та ефективної процедури відкликання.
Закупівля лікарських засобів може здійснюватись лише у суб'єктів господарювання, що мають ліцензію на виробництво лікарських засобів, оптову торгівлю лікарськими засобами.
У цих документах мають бути відображені всі акти купівлі і продажу із зазначенням дати купівлі або постачання, назви і кількості отриманого або поставленого лікарського засобу, назви і адреси постачальника або одержувача вантажу. При операціях між виробниками і дистриб'юторами, а також між самими дистриб'юторами документи слід складати таким чином, щоб легко можна було встановити походження і місце отримання лікарських засобів (зокрема за допомогою використання номерів серій), а також усіх постачальників або одержувачів лікарських засобів.
Повинна діяти система, що забезпечує оборотність складського запасу; правильність роботи цієї системи необхідно регулярно перевіряти. Лікарські засоби, термін придатності яких скінчився, не можна ні продавати, ні постачати; їх необхідно зберігати окремо від придатного до реалізації запасу до утилізації або знищення.
Відпуск (реалізація) лікарських засобів може проводитись:
суб'єктам господарювання, що мають ліцензії на оптову торгівлю лікарськими засобами;
суб'єктам господарювання, що мають ліцензії на виробництво лікарських засобів (для використання у виробництві);
суб'єктам господарювання, що мають ліцензії на роздрібну торгівлю лікарськими засобами;
безпосередньо закладам охорони здоров'я.
Торгівля неякісними лікарськими засобами або такими, термін придатності яких минув або на які відсутній сертифікат якості, що видається виробником, забороняється. Ліцензіат повинен мати план термінових дій для зупинення торгівлі неякісними та фальсифікованими лікарськими засобами, вилучення у разі потреби лікарських засобів з продажу та вжиття відповідних заходів щодо повернення зазначених лікарських засобів постачальнику (виробнику) або їх знищення (утилізації).
У сфері оптової реалізації лікарських засобів важлива роль відводиться належній практиці дистрибуції НПД (Сооd Distributіоп Рrасtісе - GDР). Вона являє собою сукупність правил і вимог до дистрибуції, дотримання яких забезпечує якість лікарських засобів у процесі управління та організації їх оптової реалізації на всіх її етапах. Настанови встановлюють вимоги до системи якості дистриб'ютора, в тому числі управління поставками, приміщень, обладнання, персоналу, документації, контролю якості, проведення самоінспекцій тощо, які враховують директиви Європейського Співтовариства та рекомендації Всесвітньої організації охорони здоров'я. Дотримання цих вимог гарантує, що рівень якості лікарських засобів, гарантований виробником, підтримується в мережі дистрибуції відповідно до встановлених стандартів якості, і лікарські засоби без будь- яких змін їх властивостей надходять для роздрібної реалізації.
Система управління та організації роботи оптових фармацевтичних підприємств повинна гарантувати, що ними:
закуповуються і реалізуються лікарські засоби, зареєстровані згідно з чинним законодавством України;
постійно дотримуються умови зберігання ліків, включаючи період транспортування;
виключена контамінація лікарських засобів іншими ліками і навпаки;
здійснюється відповідна оборотність складованих лікарських засобів;
ліки зберігаються в належних умовах та у приміщеннях, що охороняються.
Система якості ліцензіата повинна забезпечувати постачання замовнику лікарських
засобів у строк, погоджений між постачальником і замовником. Належний рівень якості лікарських засобів повинен підтримуватися в мережі оптової торгівлі без будь-яких змін їх властивостей до роздрібної торгівлі. Система простежуваності якості лікарських
засобів, створена ліцензіатом, повинна гарантувати виявлення будь-якої неякісної та фальсифікованої продукції.
У письмових стандартних робочих методиках (стандартних операційних процедурах) повинні бути описані будь-які роботи, що можуть вплинути на якість лікарських засобів або якість дистриб'юторської діяльності: отримання і перевірка поставок, зберігання лікарських засобів, очищення і обслуговування приміщень (включаючи боротьбу зі шкідливими комахами і тваринами), реєстрація умов зберігання, безпечне зберігання як запасів на складі, так і транзитних консигнаційних поставок, які взято із призначеного для продажу запасу, ведення і зберігання документації, у тому числі документів щодо замовлень лікарських засобів іншими суб'єктами господарювання, повернення лікарських засобів, плани відкликання. Ці методики мають бути затверджені, датовані і підписані уповноваженою особою суб'єкта господарювання.
З метою підвищення рівня забезпечення якості лікарських засобів в Україні запроваджена сертифікація суб'єктів господарювання, які здійснюють оптову реалізацію (дистрибуцію) лікарських засобів, па відповідність вимогам НПД. Сертифікація або процедура письмового засвідчення відповідності підприємства або його окремих структурних підрозділів правилам НПД здійснюється Держлікінспекцією. Процедура сертифікації включає такі етапи: подання заяви власником ліцензії на оптову торгівлю лікарськими засобами до Держлікінспекції про видачу сертифіката => підготовку до інспектування => проведення інспектування => складання звіту про інспектування => прийняття рішення щодо видачі сертифіката => оформлення та видачу сертифіката.
Термін дії сертифіката становить не більше 5 років і не може перевищувати терміну дії ліцензії на оптову торгівлю лікарськими засобами, зазначеного у заяві про видачу сертифіката.
Характеристика оптових фармацевтичних підприємств
При всій схожості ринкової діяльності оптових фармацевтичних фірм, в їх організаційних структурах спостерігаються певні розходження, що обумовлює класифікаційні відмінності посередників (рис. 1.4). Насамперед різниця визначається формою власності. В Україні функціонують державні (ДАК "Ліки України"), комунальні (аптечні склади обласного підпорядкування), колективні (наприклад, львівське АТ "Данфарм") і приватні (наприклад, харківська приватна фірма "Мегаполіс") оптові фармацевтичні підприємства, а також фірми з частковою (СП ТзОВ "Гедеон Ріхтер - Укрфарм" у м. Києві) та стовідсотковою (київська фірма "Прогек-фарма") іноземною інвестицією.
Інша відмінність визначається кількісним і якісним складом працівників та економічними результатами діяльності фармацевтичної фірми. З цих позицій прийнято виділяти малі, середні і великі оптові підприємства.
На малих оптових фармацевтичних фірмах працює до 25 осіб. Місячний оборот діяльності в них не перевищує 100 тис. умовних одиниць. Середній за розмірами фармацевтичний оптовий посередник може налічувати від 25 до 100 осіб, а їх місячний товарообіг - до 500 тис. умовних одиниць. На великих оптових фармацевтичних підприємствах зайнято більше 100 осіб, місячний товарообіг досягає 1-2 млн умовних одиниць, їх діловими партнерами-постачальниками виступають фармацевтичні компанії з країн Європи, Азії та Америки. Рівень сервісу, який пропонують великі фармацевтичні оптові фірми, впритул наближається до світових стандартів. Кількість останніх не перевищує 15 фірм.
Провідними за обсягом реалізації в 2007 р. серед 348 оптових підприємств були: Альба Україна (м. Бориспіль Київської обл.), БаДМ (м. Дніпропетровськ), Оптіма- Фарм, ВВС-ЛТД і Артур-К (усі - м. Київ), група компаній "Аптечний холдинг" (м. Донецьк), Фармако (м. Київ), Едельвейс (м. Львів), Фра-М (м. Донецьк), Вента (м. Дніпропетровськ), Фалбі (м. Київ), Протек-фарма і Галафарма (обидві - м. Київ), Медфармком (м. Одеса), оптова компанія "Дарниця" (м. Київ). Вони забезпечують щонайменше дві третини загального обсягу національного оптового фармацевтичного ринку.
З позиції охоплення території держави, оптових посередників можна розділити на такі групи:
1 .Національні оптові фармацевтичні фірми, які через територіальні представництва, філії, аптечні склади, фірмові аптеки постійно розробляють усі економічні регіони країни (схід, захід, центр, північ, південь). Так, фірма "Артур-К" (м. Київ) здійснює свою діяльність через 11 регіональних аптечних складів та 7 представництв і власну аптечну мережу (22 роздрібні точки), підприємство "Фалбі" (м. Київ) - через 16 територіальних філій і представництв та 49 аптек. Інші оптові фірми (наприклад, столичні підприємства "ВВС-ЛТД" та "Оптіма-фарм") розробляють регіональні ринки лише через територіальні аптечні склади (їх у них 15 і 14 відповідно). Для таких фірм характерна відсутність роздрібної мережі. Більшість із них не планують її розвитку з причин можливої конкуренції стосовно аптек-партнерів та конфлікту інтересів між оптовими та роздрібними підрозділами. Оптові структури провідних вітчизняних виробників також відіграють роль національних посередницьких фірм. Для прикладу, оптова компанія "Дарниця" має 18 територіальних представництв і філій, а "Фармація-2000" (фірма-філіал виробника "Фармак") представлена вії обласних центрах.
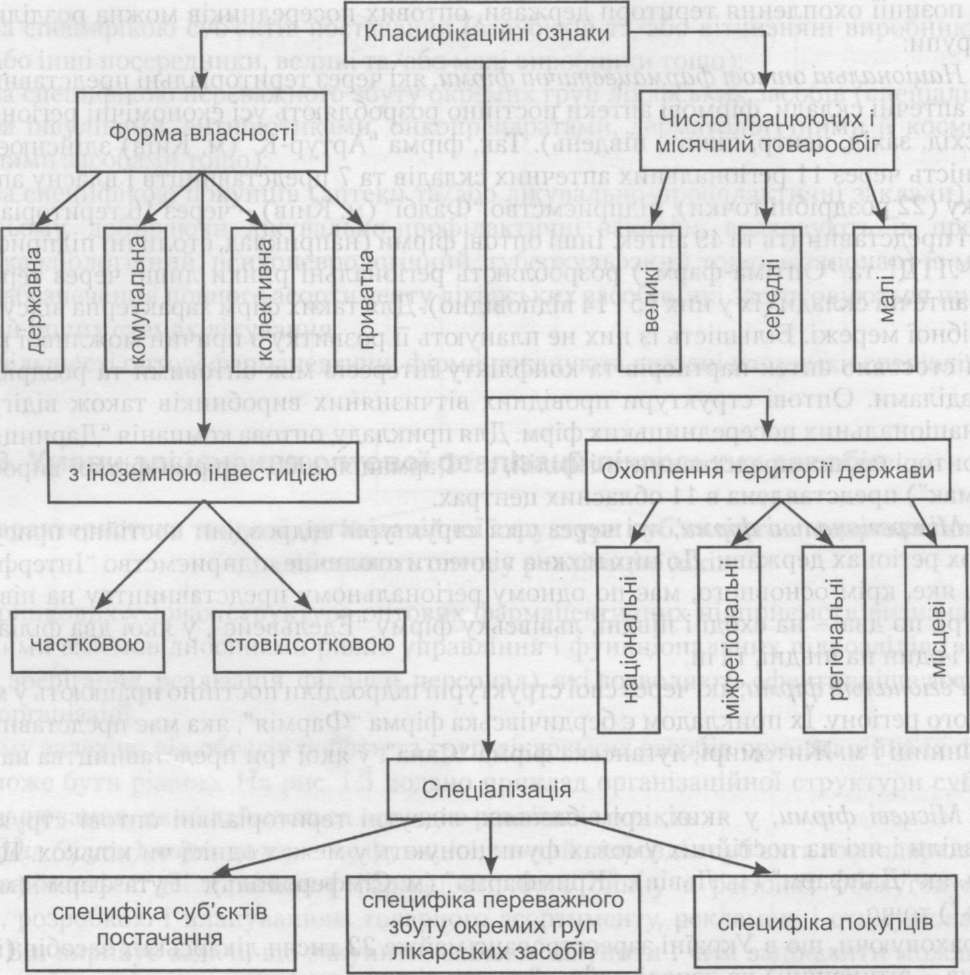
Рис. 1.4. Принципи класифікації оптових фармацевтичних фірм
Міжрегіональні фірми, які через свої структурні підрозділи постійно присутні в кількох регіонах держави. До них можна віднести столичне підприємство "Інтерфарма- Київ", яке, крім основного, має по одному регіональному представництву на півночі і в центрі, по два - на сході і півдні, львівську фірму "Едельвейс", у якої два філіали на заході і один на півдні, та ін.
Регіональні фірми, які через свої структурні підрозділи постійно працюють у межах окремого регіону. їх прикладом є бердичівська фірма "Фармія", яка має представництва у м. Вінниці і м. Житомирі, луганська фірма "Сана", у якої три представництва на сході країни.
Місцеві фірми, у яких, крім базових, відсутні територіальні оптові структурні підрозділи і які на постійних умовах функціонують у межах однієї чи кількох. Це такі фірми, як "Данфарм" (м. Львів), "Кримфарма" (м. Сімферополь), "Рута-фарм" (м. Тернопіль") тощо.
Враховуючи, що в Україні зареєстровано майже 22 тисяч лікарських засобів (із них третина - вітчизняні) на основі майже 3 тисяч діючих речовин і їх комбінацій та понад 4 тисячі виробів медичного призначення, а пропозиції найбільших оптових фармацевтичних підприємств рідко перевищують 4 тисячі назв, то їх успішне функціонування найбільше визначають дві базові концепції: асортиментний процес та спеціалізація.
Асортиментний процес полягає у формуванні та позиціонуванні товарного асортименту, необхідного конкретним споживачам, і включає три основні етапи:
концентрування, тобто формування оптимальних товарних запасів на основі закупівлі лікарських засобів різних виробників із метою своєчасного та повного задоволення потреб аптек і лікувально-профілактичних закладів;
змішування, під яким розуміється процес відбору й групування лікарських засобів в окрему партію згідно із замовленнями покупців;
розподіл, суть якого полягає у поставці окремих партій лікарських засобів покупцям у задане місце й час.
Надбудовою асортиментного процесу оптових фармацевтичних підприємств є спеціалізація, яка представляє собою організаційну форму їх збутової політики. Можна виділити три основні напрями спеціалізації:
за специфікою суб'єктів постачання (зарубіжні та/або вітчизняні виробники та/ або інші посередники, великі та/або малі виробники тощо);
за специфікою переважного збуту окремих груп лікарських засобів (спеціалізація за інсулінами, антибіотиками, онкопрепаратами, дерматологічними й косметичними засобами тощо);
за специфікою покупців (аптеки та/або лікувально-профілактичні заклади). При цьому, добираючи лікувально-профілактичні заклади, враховують їх профіль (кардіологічний, психоневрологічний, туберкульозний тощо, стаціонар) із метою забезпечення повного асортименту лікарських засобів, які застосовуються при тих чи інших схемах лікування.
У більшості оптові фармацевтичні фірми поєднують вказані напрямки спеціалізації.
Організаційні вимоги до суб'єкта господарювання, який провадить діяльність з оптової торгівлі лікарськими засобами
Суб'єкт господарювання, який провадить діяльність з оптової торгівлі лікарськими засобами, відповідно до Ліцензійних умов провадення господарської діяльності, виробництва лікарських засобів, оптової, роздрібної торгівлі лікарськими засобами повинен:
забезпечити відповідність матеріально-технічної бази вимогам нормативних документів щодо виробництва, зберігання, контролю якості, торгівлі лікарськими засобами;
забезпечити дотримання вимог законодавства щодо якості лікарських засобів, у т. ч. призначених для клінічних досліджень, під час їх транспортування, зберігання та торгівлі;
мати у наявності чинні нормативні документи, які регулюють діяльність з оптової торгівлі лікарськими засобами, та документи, що описують окремі стадії технологічного процесу (прийом, вхідний контроль, зберігання, комплектація та відпуск лікарських засобів) на аптечному складі (базі), які мають бути затверджені, датовані і підписані в установленому ліцензіатом порядку;
у кожному аптечному складі (базі) призначити принаймні одну уповноважену особу, на яку покладаються відповідні повноваження і відповідальність за створення, впровадження та функціонування системи якості. Уповноважена особа повинна особисто виконувати свої обов'язки, мати вищу фармацевтичну освіту та стаж роботи за спеціальністю не менше двох років;
мати план термінових дій, які забезпечують виконання наказів, вимог МОЗ та Держлікінспекції щодо зупинення торгівлі, вилучення із торгівлі лікарських засобів і вжиття відповідних організаційних заходів щодо повернення продавцю (виробнику) зазначених лікарських засобів або їх знищення та утилізації.
зберігати та надавати контролюючим органам для перевірок документи, що фіксують закупівлю, зберігання, транспортування, торгівлю, знищення або утилізацію лікарських засобів для оптової та роздрібної торгівлі лікарськими засобами;
для спеціалістів, діяльність яких безпосередньо пов'язана з оптовою торгівлею лікарськими засобами, мати затверджені посадові інструкції, у яких викладені основні функції, професійні знання, компетенція та інші вимоги до працівників.
зберігати протягом не менше трьох років документи, що засвідчують факт купівлі або продажу із зазначенням дати, назви, кількості та серії отриманих та поставлених лікарських засобів, інформації про покупця (постачальника) та реквізитів його ліцензії. Повинна бути забезпечена можливість відстеження руху кожної серії лікарського засобу;
зберігати протягом трьох років сертифікати якості виробника (копії на паперових чи скановані копії на електронних носіях) на серії аптечного товару, реалізованого суб'єктом господарювання;
мати паспорт аптечного складу (бази).
Паспорт являє собою документ, складений суб'єктом господарювання і погоджений з територіальними органами державної санітарно-епідеміологічної служби, державного контролю якості лікарських засобів та місцевими органами виконавчої влади. Форма паспорта затверджується Кабінетом Міністрів України. Він засвідчує відповідність наявних приміщень та устаткування аптечного закладу встановленим вимогам і можливість їх використання для оптової торгівлі лікарськими засобами. Висновок паспорта оформлюється і погоджується на одній сторінці відповідно до постанови Кабінету Міністрів України. Розміщення погоджень на окремій сторінці не допускається.
Аптечний склад (база) повинен забезпечити його своєчасне переоформлення у разі:
зміни найменування юридичної особи або прізвища, імені, по батькові фізичної особи - суб'єкта підприємницької діяльності;
зміни місцезнаходження юридичної особи або місця проживання фізичної особи - суб'єкта підприємницької діяльності;
зміни площ та складу приміщень аптечного складу (бази).
Аптечні склади (бази) повинні мати власну назву або порядковий номер.
Ліцензіат повинен мати достатню (залежно від потужності аптечної бази чи аптечного складу) кількість кваліфікованих працівників. Особи, які безпосередньо займаються оптовою торгівлею лікарськими засобами, повинні мати:
а) диплом державного зразка про фармацевтичну освіту;
б) сертифікат про присвоєння (підтвердження) звання провізора загального профілю (для фахівців, які закінчили вищий учбовий заклад після 1992 року).
Зазначена норма не поширюється на працівників аптечних складів (баз), які здійснюють відбір, комплектацію та пакування замовлень. Ці працівники повинні пройти навчання відповідно до закріплених за ними обов'язків та медичний огляд.
Фахівці, які пройшли спеціальну підготовку у навчальних закладах іноземних країн, допускаються до професійної діяльності після перевірки їх кваліфікації. Ліцензіат повинен забезпечити підвищення кваліфікації персоналу, діяльність якого може вплинути на якість продукції, факти підвищення кваліфікації необхідно протоколювати. Спеціалісти, які не працюють більше п'яти років за зазначеною у дипломі, сертифікаті (посвідченні) спеціальністю, можуть бути допущені до діяльності оптової торгівлі лікарськими засобами тільки після проходження перепідготовки.
Посади завідувачів, заступників завідувачів аптечної бази (складу) можуть заміщатися лише фахівцями з вищою фармацевтичною освітою (провізорами). Не допускається займання посади завідувача аптечної бази (складу) за сумісництвом. Керівний персонал аптечного складу (бази), де зберігаються лікарські засоби, повинен мати достатні повноваження, відповідну кваліфікацію і досвід для забезпечення належного зберігання лікарських засобів і поводження з ними.
Працівники аптечних баз (складів) при прийманні на роботу проходять медичне обстеження, а надалі - періодичний медичний огляд згідно з діючими вимогами.
Завдання та функції аптечних складів (баз)
Аптечний склад (база) - заклад охорони здоров'я, який функціонує з дозволу і під контролем державних органів, основне завдання якого полягає в забезпеченні лікарськими засобами інших суб'єктів оптової або роздрібної торгівлі, закладів охорони здоров'я та виробників лікарських засобів шляхом здійснення ним оптової реалізації (торгівлі).
У відповідності до основного завдання на аптечний склад (базу) покладаються такі основні функції:
визначення поточної потреби в лікарських засобах і виробах медичного призначення;
своєчасне замовлення необхідного товару. Закупівля лікарських засобів може здійснюватись лише у суб'єктів господарювання, що мають ліцензію на виробництво лікарських засобів, оптову торгівлю лікарськими засобами;
отримання товару від постачальників (розвантаження і приймання);
вхідний контроль якості лікарських засобів;
внутрішньоскладське транспортування;
розміщення і належне зберігання;
контроль за товарними запасами;
комплектування замовлень покупців. Відпуск лікарських засобів може проводитись суб'єктам господарювання, що мають ліцензії: на оптову торгівлю лікарськими засобами, або на виробництво лікарських засобів (для використання у виробництві), або на роздрібну торгівлю лікарськими засобами, а також безпосередньо закладам охорони здоров'я;
транспортування замовлень;
збір і доставка порожніх товароносіїв;
контроль за виконанням замовлень;
заміна замовленого товару;
вилучення з обігу, відповідна ідентифікація та розміщення в чітко визначених та промаркованих місцях (карантинних зонах) неякісних, підроблених (фальсифікованих) і незареєстрованих лікарських засобів; ліків, термін придатності яких минув; заборонених до реалізації в установленому законодавством порядку;
лікарські засоби з ушкодженими закупорювальними елементами або упаковками; ліків, відносно яких є припущення, що вони є неякісні; повернених лікарських засобів. Подальші дії з вказаними лікарськими засобами здійснюються відповідно до чинного законодавства та порядку, встановленого у суб'єкта господарювання.
Вимоги до приміщень аптечних складів (баз)
Аптечні склади (бази) розміщуються в окремо розташованих спеціально улаштованих будинках, в ізольованих приміщеннях у громадських будинках, а також допоміжних будинках промислових підприємств на будь-якому поверсі за умови влаштування вантажно-розвантажувальної площадки для під'їзду машин (рампа з навісом тощо) поза фронтом вікон приміщень з постійним перебуванням людей. При цьому складські приміщення для зберігання вогненебезпечних та вибухонебезпечних речовин повинні бути ізольовані, захищені від світла прямих сонячних променів, атмосферних опадів та ґрунтових вод. Розміщення таких приміщень у підвалах, напівпідвалах та в цокольних поверхах не допускається. Для оптової торгівлі медичними газами аптечні склади (бази) повинні відповідати вимогам, визначеним законодавством.
Розміщення аптечних баз (складів) у житлових будинках, спортивних спорудах, школах, учбових і дитячих дошкільних закладах, закладах культури, спорту, освіти та соціального забезпечення, лікувально-профілактичних закладах, магазинах допускається за умови експлуатації відповідних відокремлених будівель не за призначенням.
Електрозабезпечення, опалення, освітлення, вентиляція, температура і вологість повітря у складських приміщеннях (зонах) повинні відповідати будівельним і санітарним нормам і правилам та не впливати негативно (прямо чи опосередковано) на діючу речовину (субстанції), готові лікарські засоби.
Аптечні бази (склади) повинні бути обладнані приладами центрального опалення або іншими автономними системами опалення, які відповідають нормам пожежної безпеки. Не допускається опалення приміщень газовими приладами з відкритим полум'ям або електронагрівальними приладами з відкритою електричною спіраллю. Зазначена вимога не поширюється на приміщення аптечних складів (баз) суб'єктів господарювання, які займаються оптовою торгівлею виключно медичними газами.
На фасаді будівлі, де розміщується аптечний заклад, повинна бути вивіска з позначкою "Аптечний склад" чи "Аптечна база", що не вважається рекламою. Крім цього, перпендикулярно до стіни будівлі кріпиться зовнішній сигнальний покажчик. Він являє собою рівносторонній хрест зеленого кольору, у центрі якого розміщено зображення чаші зі змією, яка її обвиває, білого кольору. Габаритні розміри зовнішнього сигнального покажчика повинні бути не менше 400 мм і він повинен освітлюватися у темний період доби.
Аптечні склади (бази) повинні мати:
• виробничі приміщення: площі (зони) для приймання і зберігання лікарських засобів та їх відпуску, допоміжних матеріалів і тари загальною площею не менше ніж 250 кв. м. Склад, розташування виробничих приміщень (зон) та їх площа повинні забезпечувати послідовність технологічного процесу (приймання, контроль якості, зберігання, комплектація та відпуск лікарських засобів); повинні бути відповідно обладнані окремі площі (зони) або приміщення для зберігання лікарських засобів, які потребують особливих умов зберігання (сильнодіючі, отруйні, наркотичні, психотропні, імунобіологічні, термолабільні, вогненебезпечні, легкозаймисті, вибухонебезпечні препарати, лікарська рослинна та інша сировина);
службово-побутові і допоміжні приміщення, мінімальний набір яких та їх площа визначаються ДБН В.2.2-10-2001: кімната персоналу (0,75 кв. м на одного працівника, але не менше 8 кв. м.), туалет (не менше 2 кв. м.), приміщення для зберігання предметів прибирання (4 кв. м) або шафа залежно від обсягу роботи. У склад приміщень аптечного складу (бази) залежно від його потужності можуть включатися адміністративні приміщення з розрахунку 4 кв. м на одного керівного працівника.
Лікарські засоби у виробничих складських приміщеннях повинні зберігатися на стелажах, піддонах, підтоварниках, у шафах, холодильному та іншому спеціальному обладнанні для забезпечення умов зберігання лікарських засобів відповідно до діючих вимог. Зазначена вимога не поширюється на приміщення аптечних складів (баз) суб'єктів господарювання, які займаються оптовою торгівлею виключно медичними газами.
Заборонено зберігання у приміщеннях аптечних складів (баз):
лікарських засобів, що їм не належать, крім випадків, передбачених законодавством та нормативно-правовими актами МОЗ України;
інших товарів, крім лікарських засобів та супутніх товарів, визначених МОЗ України.
Для підтримання чистоти повітря приміщення для зберігання повинні бути обладнані припливно-витяжною вентиляцією з механічним спонуканням (або змішаною природною витяжною вентиляцією з механічною припливною), яка забезпечує повітряно- тепловий баланс приміщень. Зазначена вимога не поширюється на приміщення аптечних складів (баз) суб'єктів господарювання, які займаються оптовою торгівлею виключно медичними газами.
Складські приміщення повинні бути забезпечені засобами вимірювальної техніки температури та відносної вологості. Для кожного виробничого приміщення повинні бути забезпечені реєстрація та контроль температури і відносної вологості. Записи про температуру і відносну вологість слід регулярно перевіряти. Ліцензіат повинен забезпечувати справність усіх засобів вимірювальної техніки та проведення їх регулярної метрологічної повірки. У разі необхідності особливих температурних умов зберігання зони зберігання мають бути обладнані приладами, що записують температуру, або іншими приладами, що фіксують дотримання температури у потрібному діапазоні. Щоб підтримувати необхідну температуру в усіх частинах відповідної зони зберігання, слід здійснювати систематичний контроль.
Зони (приміщення) приймання лікарських засобів та відпуску мають бути відокремлені від зон зберігання і забезпечувати належний захист поставлених лікарських засобів від негоди під час вантажних робіт.
За наявності на аптечній базі (складі) імунобіологічних препаратів загальний об'єм холодильного обладнання повинен забезпечувати відповідно до діючих вимог зберігання всієї кількості зазначених ліків, що містяться на базі (складі).
Ліцензіат під час транспортування лікарських засобів повинен забезпечити умови зберігання лікарських засобів відповідно до вимог, встановлених виробником.
Транспортний засіб для перевезення лікарських засобів повинен забезпечувати дотримання визначених виробником умов зберігання ліків і дозволяти проведення систематичного вологого прибирання з використанням дезінфікуючих засобів.
Забороняється транспортування лікарських засобів громадським транспортом, рейсовими автобусами міжміського сполучення, залізничним транспортом для пасажирських перевезень, у поштових відправленнях.
Матеріали для покриття стін, стелі, підлоги виробничих приміщень аптечної бази (складу) повинні допускати вологе прибирання з використанням дезінфікуючих засобів. Поверхня виробничого устаткування, як ззовні, так і всередині, повинна бути гладенькою, виготовленою з матеріалів, стійких до дії лікарських засобів, витримувати обробку дезінфікуючими розчинами. Устаткування виробничих приміщень повинне розташуватися таким чином, щоб не залишалися місця, недоступні для прибирання.
Приміщення та устаткування кімнати персоналу аптечної бази (складу) повинні забезпечити утримання та схоронність особистого та спеціального одягу відповідно до вимог санітарно-епідемічного режиму, а також можливість уживання їжі та відпочинку (обладнані шафами для одягу, холодильником, меблями).
Санітарний стан приміщень та устаткування аптечної бази (складу) повинен відповідати вимогам наказу МОЗ України № 275 від 15 травня 2006 р. Підлогу миють не рідше одного разу за зміну, стіни і двері - не рідше одного разу на тиждень із застосуванням дезінфекційних засобів, стелю - один раз на місяць очищають від пилу вологим способом. Устаткування приміщень підлягає зовнішньому прибиранню кожного дня. Раковини для миття рук та санітарні вузли чистяться і дезінфікуються також щодня. Декоративне оформлення невиробничих приміщень очищають від пилу і миють пе рідше одного разу на тиждень, а пристосування для очищення взуття від бруду - не рідше одного разу па день.
Для прибирання різних приміщень (виробничі приміщення, санітарний вузол) повинен бути виділений інвентар (відра, тази, щітки, ганчір'я тощо), який маркується і використовується тільки за призначенням. Зберігають його у спеціально визначеному місці (кімната, шафа) окремо за призначенням.
Здійснення у приміщеннях аптечних складів (баз) під час зберігання лікарських засобів ремонтних робіт, що можуть призвести до зміни умов зберігання лікарських засобів, передбачених нормативними документами, та призвести до погіршення їх якості, - не допускається.
Функції основних відділів (секторів) аптечних складів (баз)
Як видно з даних рис. 1.5 (див. с. 44), до основних відділів (груп) аптечних складів (баз) належать: приймальний та оперативні відділи і відділ експедиції.
Приймальний відділ (група) - структурний підрозділ аптечного складу, який здійснює приймання товару від постачальників, оперативний контроль за його надходженням, розшук своєчасно не отриманих вантажів, документальне оформлення і передачу прийнятого товару в оперативні (товарні) відділи складу.
У відповідності з Особливими умовами поставки медичної продукції, якщо інше не зазначено в угоді, лікарські засоби аптечному складу (базі) повинні відпускатися з залишковим терміном придатності не менше 80 %, а бактерійні препарати - не менше 60 %.
Приймання товару за кількістю, якістю і вартістю здійснює приймальна комісія, головою якої призначається завідувач приймального відділу або його заступник (він же - уповноважена особа з вхідного контролю якості ліків), а членами комісії - завідуючі відповідними оперативними відділами. При малих обсягах товарообігу цю роботу здійснює уповноважена особа, тобто фахівець з вищою або, як виняток для сільської місцевості, середньою фармацевтичною освітою та стажем роботи за фахом не менше 2 років, на якого згідно з наказом керівника оптової фармацевтичної фірми покладено здійснення вхідного контролю якості ліків.
Оперативні (товарні) відділи або виробничі приміщення складу призначені для розміщення і зберігання отриманих від приймального відділу (групи) лікарських засобів і виробів медичного призначення у відповідності з чинними принципами (докладніше викладено у підтемі 3.3). Кількість оперативних відділів визначається згідно з обсягами та асортиментом лікарських засобів, що зберігаються. Серед оперативних відділів (приміщень зберігання) повинні бути відділи: отруйних, наркотичних, психотропних лікарських засобів і прекурсорів, зберігання спирту етилового, різних груп лікарських засобів з урахуванням їх фізико-хімічних властивостей та дії на них різноманітних факторів зовнішнього середовища. Крім цього, на складі повинен бути відділ, виробниче приміщення або зона зберігання тари і товароносіїв.
Структурним підрозділом аптечного складу, який здійснює пакування товарів, що надійшли з оперативних відділів, розподіл їх по покупцях, оформлення транспортних документів, а також передачу товару аптекам у разі самовивозу, є відділ (група) експедиції.
Обов'язки уповноваженої особи аптечного складу (бази) та методика вхідного контролю якості лікарських засобів
Вхідний контроль якості лікарських засобів на аптечних складах (базах) здійснює уповноважена особа, призначена наказом керівника суб'єкта господарської діяльності. Уповноважена особа - це фахівець з повною вищою фармацевтичною освітою або, як виняток для сільської місцевості, середньою фармацевтичною освітою та стажем роботи за фахом не менше 2 років, на якого суб'єктом господарювання покладено відповідальність за функціонування системи забезпечення якості лікарських засобів в аптечному закладі та надання дозволу на торгівлю лікарськими засобами. Її прізвище, контактний телефон та форму зв'язку (телефон, факс, електронна пошта) слід повідомляти обласній (міській) державній інспекції з контролю якості лікарських засобів (далі - територіальній інспекції). До компетенції уповноваженої особи належить підготовка та оформлення висновку по результатах вхідного контролю якості серій лікарських засобів з відміткою про передачу їх до реалізації.
Головними обов'язками уповноваженої особи є:
перевірка лікарських засобів, які надходять на аптечний склад (базу), і супровідних документів - накладних (з обов'язковим зазначенням назви, дозування, лікарської форми, номера серії, кількості, найменування виробника), висновків стосовно якості, що видаються виробниками, відомостей про державну реєстрацію лікарського засобу;
ведення реєстру лікарських засобів, які надійшли до суб'єкта господарської діяльності, щоб мати змогу відстежити джерело одержання кожної неякісної або фальсифікованої партії лікарських засобів;
ведення реєстру лікарських засобів, які реалізуються аптечним складом (базою), щоб мати змогу відкликати партії неякісних або фальсифікованих лікарських засобів;
перевірка наявності на складі неякісних та фальсифікованих серій лікарських засобів згідно з інформацією територіальної інспекції;
надання територіальній інспекції відомостей про виявлені неякісні та фальсифіковані Лікарські засоби або про які є підозра щодо їх якості; призупинення відпуску та поміщення в карантин таких лікарських засобів.
Вхідний контроль якості лікарських засобів полягає в тому, що:
1.Закуповувати і одержувати лікарські засоби слід тільки у суб'єктів, які мають чинні ліцензії на право оптової торгівлі або виробництва лікарських засобів. Копії таких ліцензій повинні зберігатися в уповноваженої особи.
2.Одержані лікарські засоби повинні пройти візуальний контроль уповноваженою особою, позитивний письмовий висновок якої є дозволом для реалізації цих лікарських засобів.
3.Уповноважена особа перевіряє відповідність одержаних лікарських засобів супровідним документам щодо кількості, дозування, номерів серій, термінів придатності, реєстраційного статусу, назви лікарської форми, виробника. Кожна серія лікарських засобів повинна супроводжуватися сертифікатом якості, що видається виробником. Лікарські засоби, що підлягають обов'язковій лабораторній перевірці (перелічені па с. 17), повинні додатково супроводжуватися сертифікатом аналізу, виданим лабораторією, що підпорядкована або уповноважена територіальною інспекцією.
4.Групова тара, зовнішня (вторинна) та внутрішня (первинна) упаковки, маркування, листок-вкладка, зовнішній вигляд без розкриття упаковки перевіряються на цілісність, однорідність, наявність пошкоджень, якість пакувальних матеріалів. При потребі, якщо виникла підозра щодо якості, лікарські засоби перевіряються з розкриттям упаковок на предмет розмірів, форми, кольору, однорідності, кількості одиниці) в упаковці, наявності забруднень.
5.При позитивному результаті вхідного контролю уповноважена особа передає партії лікарських засобів на реалізацію. Лікарські засоби та вироби медичного Призначення, що надійшли до аптечного складу (бази), оприбутковуються після перевірки їх фактичної кількості та проведення вхідного контролю, але не пізніше наступного робочого дня з моменту отримання.
6.При негативному результаті уповноважена особа складає акт про виявлені дефекти, який є підставою для повернення серії постачальнику. Копія акта подається у територіальну інспекцію, яка після проведення додаткової перевірки та вибіркового аналізу вживає заходів щодо інформування інших суб'єктів про виявлені неякісні або фальсифіковані лікарські засоби та контролює дії постачальника щодо їх знищення, утилізації або повернення (у разі неякісних серій) виробнику.
7. У випадку виникнення сумніву щодо якості лікарських засобів уповноважена особа відбирає зразки сумнівних лікарських засобів та направляє їх у територіальну інспекцію для проходження лабораторних досліджень. На час проведення таких досліджень, до остаточного вирішення питання про їх якість, партія сумнівних лікарських засобів перебуває у карантині, ізольовано від інших лікарських засобів, з позначкою "Торгівля заборонена до окремого розпорядження".
Лікарські засоби, які потребують особливих умов зберігання, повинні бути негайно ідентифіковані і розміщені у відповідних приміщеннях (зонах) зберігання згідно з вимогами чинного законодавства.
Лікарські засоби та товари, що надійшли до аптечного закладу, оприбутковуються після перевірки їх фактичної кількості та проведення вхідного контролю, але не пізніше наступного робочого дня з моменту отримання.
Особливості зберігання наркотичних і психотропних речовин та прекурсорів
Зберігання наркотичних і психотропних засобів списку № 1 регламентується наказом МОЗ України № 356 від 18.12.97 р. Незалежно від лікарської форми вказані препарати повинні зберігатися в окремій матеріальній кімнаті, двері якої оббиті залізом, на вікнах — металеві решітки. Крім цього, матеріальна кімната повинна бути обладнана світло-звуковою охоронною сигналізацією, яка виведена на пульт служби охорони державних об'єктів. Наркотичні і психотропні лікарські засоби та прекурсори списку № 1 зберігаються в замкнених вогнетривких сейфах, їх запаси в аптеках, що знаходяться в одному населеному пункті з аптечним складом, не повинні перевищувати двотижневого нормативу зберігання. В інших аптеках норматив зберігання встановлюється ДКП "Фармація" чи аптечними управліннями держадміністрацій в залежності від відстані аптек до аптечних складів (табл. 3.1).
Для зберігання психотропних лікарських засобів і прекурсорів списку № 2 можуть бути використані замкнені металеві шафи, надійно прикріплені до підлоги чи стіни.
На внутрішній поверхні дверцят сейфа, в якому зберігаються наркотичні і психотропні лікарські засоби та прекурсори списку № 1, повинні бути надписи "Наркотичні засоби", "Психотропні засоби", "Прекурсори" з переліком усіх засобів та зазначенням їх вищих разових і добових доз.
Доступ до матеріальних мають право лише особи, що безпосередньо допущені до роботи, пов'язаної з обігом наркотичних і психотропних лікарських засобів та прекурсорів списку № 1. Порядок доступу і перебування в матеріальній та перелік посадових осіб, які мають право займатися такою роботою, визначається письмовим наказом завідувача аптеки. У матеріальній кімнаті повинні бути терези, ручні ваги, лійки, ступки, циліндри, інший посуд і інвентар, їх миття та обробка здійснюються тільки під контролем фармацевтичного фахівця, окремо від іншого посуду.
Матеріальна кімната, сейфи і металеві шафи після операцій з наркотичними і психотропними лікарськими засобами та прекурсорами списку № 1 зразу ж потрібно замикати, а після закінчення робочого дня - опечатувати чи пломбувати і здавати під охорону. Ключі від матеріальної, сейфів і металевих шаф повинні знаходитися у завідувача аптеки або матеріально відповідальної особи, уповноваженої письмовим наказом по аптеці.
№ з/п |
Місце зберігання |
Запаси лікарських засобів |
|
наркотичних, психотропних та прекурсорів списку № 1 |
отруйних і сильнодіючих, які підлягають предметно-кількісному обліку |
||
1. |
Матеріальні кімнати: |
||
1.1. |
міських аптек |
не більше двотижневого нормативу зберігання в місцях дислокації аптечних складів |
не більше місячного нормативу зберігання |
1.2. |
інших аптек |
встановлюється ДКП "Фармація" чи аптечними управліннями держадміністрацій в залежності від відстані аптек до аптечних складів |
не повинна перевищувати загального нормативу товарних запасів у днях, встановленого для даної аптеки |
2. |
Асистентські кімнати |
протягом робочого дня в кількостях, необхідних для виготовлення ліків |
не більше п'ятиденного нормативу зберігання |
3. |
У чергових аптеках (на ніч) |
у кількостях, необхідних для надання невідкладної допомоги |
|
В асистентських кімнатах запаси наркотичних і психотропних лікарських засобів та прекурсорів списку № 1 повинні зберігатися в зачиненому вогнетривкому сейфі тільки протягом робочого дня в кількостях, необхідних для роботи. Видача вказаних засобів з матеріальної в асистентську для поточної роботи проводиться тільки завідувачем аптеки або уповноваженою на це наказом по аптеці матеріально відповідальною особою.
В робочий час ключі від сейфа зберігаються у матеріально відповідальної особи, уповноваженої письмовим наказом по аптеці. Після закінчення робочого дня невикористані засоби повертаються в матеріальну кімнату.
У чергових аптеках запаси наркотичних і психотропних лікарських засобів та прекурсорів списку № 1 (на ніч) не повинні перевищувати кількості, необхідної для надання невідкладної допомоги. Вони зберігаються у сейфі, який після закінчення чергування опечатується чи пломбується
