
- •Методичні вказівки до лабораторних робіт
- •Мелітополь – 2012
- •Лабораторна робота №1 приготування розчинів
- •Вимоги до знань і умінь
- •Теоретична частина
- •Лабораторна робота № 2 полімерні матеріали
- •Вимоги до знань і умінь
- •Теоретична частина
- •Природні високомолекулярні сполуки
- •Віскоза – одержують із целюлози і сірки. Із неї роблять целофан, віскозний шовк і т. Д.
- •Лабораторна робота №3 жорсткість води
- •Лабораторна робота № 4 загальні властивості металів
- •Лабораторна робота № 5 гальванічні елементи.
- •Паспорт роботи
- •Лабораторна робота № 6 електроліз
- •Лабораторна робота № 7 аналіз акумуляторної кислоти
- •1. Що означає напис на акумуляторі: 6 ст – 55 а?;
- •16. Які домішки в електроліті небажані для акумулятора?
- •Лабораторна робота № 8 корозія металів
- •Додаток
- •Густина розчинів деяких кислот, лугів та аміаку при 20⁰с, г/см3
Лабораторна робота № 5 гальванічні елементи.
Мета роботи – ознайомити студентів з активністю металів, основними електрохімічними поняттями та процесами роботи гальванічних елементів.
ВИМОГИ ДО ЗНАНЬ ТА УМІНЬ
Студент повинен знати: виникнення стрибка потенціалів на кордоні розчин – електрод, теорію електродних потенціалів та методи їх виміру, анодні та катодні процеси під час роботи гальванічних елементів, визначення ЕДС гальванічних елементів.
Студент повинен вміти: використовуючи ряд напруги металів, правильно записувати рівняння реакції витіснення водню з кислоти активним металом; складати схеми гальванічних елементів та записувати рівняння реакцій, які йдуть на електродах; розраховувати значення електродних потенціалів за формулою Нернста; розраховувати ЕДС гальванічних елементів.
ТЕОРЕТИЧНА ЧАСТИНА
Величина електродного потенціалу залежить від активності металу, концентрації його іонів у розчині та температури.
Електродний потенціал розраховується за формулою Нернста:
![]() ,
,
де Е0 – стандартний електродний потенціал метала;
n – валентність іонів метала у розчині;
С – концентрація іонів метала у розчині (в г-іон/л).
Абсолютні значення потенціалів металів виміряти не вдається, тому вимірюють їх відносно водневого електроду.
Водневий електрод складається з платинової пластини, яка вкрита губчастою платиною. Електрод занурюють у розчин сірчаної кислоти, з концентрацією іонів водню 1 г-іон/л. Знизу електрод омивається струєю газоподібного водню під тиском 1 ат. Величину потенціалу такого електроду приймають за нуль.
Різниця потенціалів між металом зануреним у розчин своєї солі з концентрацією іонів металу 1 г - іон/л і водневим електродом, називається стандартним або нормальним потенціалом металу.
Гальванічні елементи - це прилади, в яких хімічна енергія окислювально-відновної реакції перетворюється в електричну.
Перший такий прилад був створено італійським фізиком - хіміком Вольта, потім вдосконалений російськими вченими Даніелем і Якобі. Їх гальванічний елемент складається з мідної та цинкової пластинок занурених у розчин своїх солей. Розчини розділені напівпроникнивною перетинкою. Якщо у зовнішній ланцюг увімкнути вольтметр, тоді ми виміряємо різницю електродних потенціалів або ЕДС елемента.
ЕДС = Е0окисл. – Евідновн.
Схематично мідно-цинковий гальванічний елемент можна записати таким чином:
(-) Zn / ZnSO4 // CuSO4 /Cu (+).
Паспорт роботи
1.Хлористоводнева кислота, НСІ. 2.Сульфат міді, CuSO4. 3.Сульфат цинку, ZnSO4. 4.Сульфат алюмінію, АІ2(SO4)3. 5.Сульфат заліза, FeSO4.
|
6.Склянки об’ємом 250 мл. 7.Електроди: мідна, цинкова, алюмінієва, залізна пластинки. 8.Войлочний місток |
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Дослід №1. Гальванічні елементи.
Нижче перелічені напівелементи з’єднайте войлочним містком, занурюючи його у розчин солей (див. малюнок).
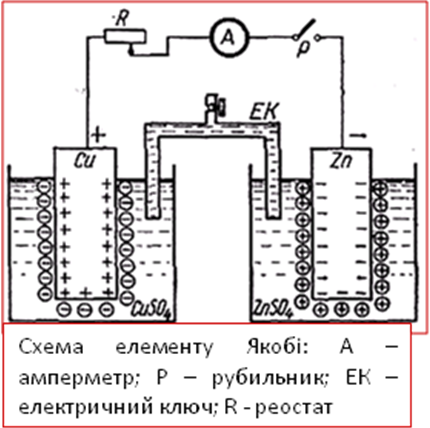
Металеві пластинки з’єднайте з вольтметром. Спостерігайте відхилення стрілки, яке свідчить про виникнення електричного струму.
Робоче місце №1. Мідну пластинку занурюють у 2,0 Н розчин сульфату міді, а цинкову – у 0,1 М розчин сульфату цинку.
Робоче місце №2. Мідяну пластинку занурюють у 2,0 Н розчин сульфату міді, а алюмінієву -–у 0,1 М розчин сульфату алюмінію.
Робоче місце №3. Мідяну пластинку занурюють у 2,0 Н розчин сульфату міді, а залізну – у 0,1 М розчин сульфату заліза.
Робоче місце №4. Цинкову пластинку занурюють у 2,0 М розчин сульфату цинку, а другу цинкову пластинку – у 0,001 М розчин сульфату цинку.
Складіть рівняння окислювально-відновних реакцій, які проходять на електродах. Розрахуйте ЕДС гальванічного елемента.
КОНТРОЛЬНІ ПИТАННЯ
Як заряджується метал у вакуумі та воді?
Як обладнаний нормальний водневий електрод та чому дорівнює його електродний потенціал?
Як виникає подвійний електродний шар?
Що зветься електродним потенціалом?
Що зветься рівноважним потенціалом, від яких факторів він залежить?
Що таке стандартний (нормальний) електродний потенціал?
Що таке ряд напруги металів?
Як змінюється в ряді напруги відновлювальна та окислювальна активності металу?
Що зветься гальванічним елементом7
Які хімічні реакції проходять у гальванічних елементах:
а) у негативного електрода?
б) у позитивному електроді?
Як розрахувати ЕДС гальванічного елемента?
Чи можна зробити гальванічний елемент з одного і того самого металу?
Що таке концентраційний гальванічний елемент?
Що таке одноразовий гальванічний елемент?
ЗАДАЧІ
1. Складіть схеми двох гальванічних елементів, в одному з яких мідь була б катодом, а у другому – анодом. Напишіть рівняння реакцій, що протікають при роботі цих елементів, і обчисліть значення стандартних е. р. с..
2. Гальванічний елемент складається із срібного електроду, що занурений в 1 М розчин AgNO3, і стандартного водневого електроду. Написати рівняння електродних процесів і сумарної реакції, що протікають при роботі елементу. Чому дорівнює його е. р. с.?
3. Е. р. с. елементу, що складається з мідного та свинцевого електродів, що занурені в 1 М розчини солей цих металів, дорівнює 0,47 В. Чи зміниться е. р. с. , якщо взяти 0,001 М розчини? Відповідь обґрунтувати.
4. Чи можливо скласти такий гальванічний елемент, у зовнішньому ланцюзі якого електрони перебігали б від електроду з більш позитивним стандартним потенціалом до електроду з більш негативним стандартним потенціалом? Дати пояснення.
5. Гальванічний елемент складається з стандартного цинкового електроду та хромового електроду, що занурений у розчин, який містить іони Cr3+. При якій концентрації іонів Cr3+ е. р. с. цього елементу буде дорівнювати нулю?
