
- •Методи вимірювання параметрів навколишнього середовища
- •1. Сучасні екологічні дослідження і їх комплексний характер
- •2. Екологічний моніторинг і його елементи
- •3. Процедури і операції технологічного циклу екоаналітичного контролю забруднення навколишнього середовища
- •Питання для самоконтролю
- •Методи контролю за станом навколишнього середовища основні вимоги до методів і засобів екоаналітичного контролю
- •1. Основні вимоги до методів і засобів екоаналітичного контролю
- •1.1. Вимоги до результатів екоаналітичних робіт
- •1.2. Вимоги до засобів вимірювань
- •1.3. Вимоги до допоміжного обладнання
- •1.4. Вимоги до випробувального обладнання
- •1.5. Вимоги до засобів метрологічного забезпечення
- •1.6. Вимоги до методик виконання вимірювань
- •1.7. Вимоги до засобів пробовідбору
- •1.8. Вимоги до технічної компетентності екоаналітичних лабораторій
- •Питання для самоконтролю
- •Класифікація і основні характеристики екоаналітичних засобів
- •Питання для самоконтролю
- •Сучасні методи дослідження стану навколишнього середовища
- •1. Якісний аналіз стану довкілля
- •Питання для самоконтролю
- •2. Кількісні методи аналізу
- •Методи визначення деяких хімічних інгредієнтів у
- •2.1. Хімічні методи
- •2.2. Фізико - хімічні методи
- •Колориметрія
- •Фотоколориметрія
- •Спектрофотометрія
- •Фотоколориметри
- •Фотоколориметр кфк - 2
- •Спектрофотометри
- •Спектрофотометр сф – 46
- •Спектрофотометр сф – 14
- •Молекулярна спектроскопія
- •Рефрактометрія. Рефрактометри
- •Поляриметрія. Прилади для поляриметричних вимірювань Поляриметрія
- •Прилади для поляриметричних вимірювань
- •Стилоскопи
- •Потенціометрія
- •Потенціометри і рН-метри
- •Кондуктометрія
- •Вольтамперомерометрія (полярографія)
- •Прилади для кулонометричних вимірювань
- •Кулонометрія при постійному контрольованому потенціалі
- •Кулонометрія при постійній контрольованій силі струму (кулонометричне титрування)
- •Електролізери
- •Хроматографічний аналіз
- •Питання для самоконтролю
- •Використана література Основна
- •Допоміжна
Стилоскопи
Стилоскопи, стилометри, спектрографи, як і полуменеві фотометри використовуються для проведення емісійного спектрального аналізу.
Конструкції спектральних приладів вельми різноманітні. Вони розрізняються за типом диспергуючого елемента, способом реєстрації спектру і т.д.
У приладах для візуального спектрального аналізу – різних стилоскопах і стилометрах| — диспергуючим| елементом є скляні призми, приймачем світла служить око спостерігача. На рис. 2.28. представлена оптична схема одного з поширених приладів – стилоскопа СЛ-11|.
Світло від джерела збудження 1 через оптичну систему 2 потрапляє на вхідну щілину 3 постійна ширина 0,02 мм і поворотною призмою 4 через об'єктив 5 прямує на диспергуючу| систему з двох призм 6 і 7. Покритий сріблом катет призми 7 відображає промені, які знов проходять диспергуючу| систему і через об'єктив 5 і поворотну призму 8 потрапляють на дзеркало 9 і далі в окуляр 11, який служить для спостереження спектру. Фотометричний клин 10 дозволяє послаблювати інтенсивність| вибраної спектральної лінії і за спеціальною шкалою, пов'язаною з клином, оцінювати її відносну інтенсивність. Призма 7 може обертатися, що призводить до переміщення спектру в полі зору, а кут повороту призми показує за шкалою, до якої області довжин хвиль відноситься спостережувана ділянка спектру. Стилоскоп призначений для роботи в спектральній області від 390 до 700 нм, для збудження спектру зазвичай використовується дуговий генератор. Елементарний фотометричний клин дозволяє підвищити точність аналізу в порівнянні із звичайними стилоскопами|.
Для виконання експресних аналітичних робіт поза лабораторією застосовують переносний стилоскоп| типу СЛП-2|, оптична схема якого лише небагато чим відрізняється від оптичної схеми СЛ-11|.
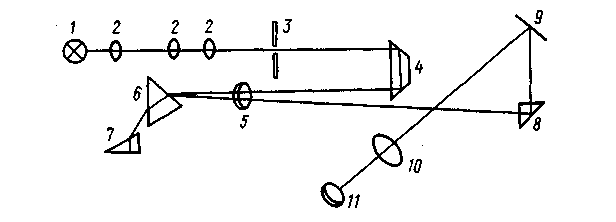
Рис. 2.28. Оптична схема стилоскопа| СЛ-11|
Складнішу, ніж у стилоскопів|, оптичну схему і пристрій мають стилометри|, наприклад стилометр| СТ-7|. Фотометрична система цього приладу дозволяє незалежно ослабляти інтенсивність двох спектральних ліній і кількісно характеризувати їх відносну інтенсивність, а також зближувати в полі зору аналітичну пару ліній, що створює зручність в роботі і підвищує точність аналізу.
Електрохімічні методи аналізу
К л а с и ф і к а ц і я. Електрохімічні методи аналізу ґрунтуються на вимірюванні електрохімічних явищ, що виникають у досліджуваному розчині або на поверхні електродів, взаємодіючих з розчином. Електрохімічні явища в розчинах можна класифікувати на три типи:
а) опір розчину електричному струму;
б) виникнення потенціалу на електродах, занурених у розчин;
в) електрохімічна реакція на електродах, що виникає при накладенні певного потенціалу.
У залежності від використаних явищ розрізняють:
потенціометрію – вимірювання потенціалів, що виникають на електродах;
кондуктометрію – вимірювання опору аналізованого розчину;
вольтамперометрію – вимірювання залежності між величиною струму і змінним потенціалом, накладеним на електроди;
електрогравіметрію – гравіметричне визначення продуктів електрохімічної реакції на електродах;
кулонометрію – вимірювання кількості електрики, пройденої через розчин речовини в ході її електрохімічного перетворення.
У всіх цих методах величина електричного сигналу пропорційна концентрації речовини. Для проведення електрохімічних вимірювань застосовують спеціальну апаратуру. Прилад для проведення електрохімічного аналізу звичайно складається з електричної комірки і пристрою вимірювання. В електрохімічну комірку поміщені електроди.
Електрохімічні комірки. Існує два типи електрохімічних комірок - гальванічний елемент і електролітична комірка. У гальванічному елементі електрохімічна реакція на електродах і електричний струм виникають самовільно, при зануренні електродів у відповідний розчин і зовнішньому контакті між електродами. Гальванічні елементи використовують для потенціометричного вимірювання концентрації речовин.
В
електролітичній
комірці
електрохімічна реакція починається
при накладанні на електроди деякого
стороннього потенціалу. Наприклад, при
зануренні в розчин СuSО4
мідного і платинового електродів
електрохімічної реакції не відбувається.
Якщо ж на електроди подати потенціал
порядком 0,7 - 0,8 В ( на Сu![]() ,
на Рt
,
на Рt![]() ), то
Сu2+
приймає від електрода два електрони і
відновлюється до Сu0.
Величина струму, що протікає при цьому
через комірку, залежить від концентрації
Сu2+.
Електролітичні комірки застосовують
у вольтамперометрії, електрогравіметрії
і кулонометрії.
), то
Сu2+
приймає від електрода два електрони і
відновлюється до Сu0.
Величина струму, що протікає при цьому
через комірку, залежить від концентрації
Сu2+.
Електролітичні комірки застосовують
у вольтамперометрії, електрогравіметрії
і кулонометрії.
Електроди. Для електрохімічних вимірювань застосовують стандартні і індикаторні електроди. Потенціал стандартних електродів постійний, потенціал індикаторних залежить від концентрації речовин і вимірюється відносно стандартних.
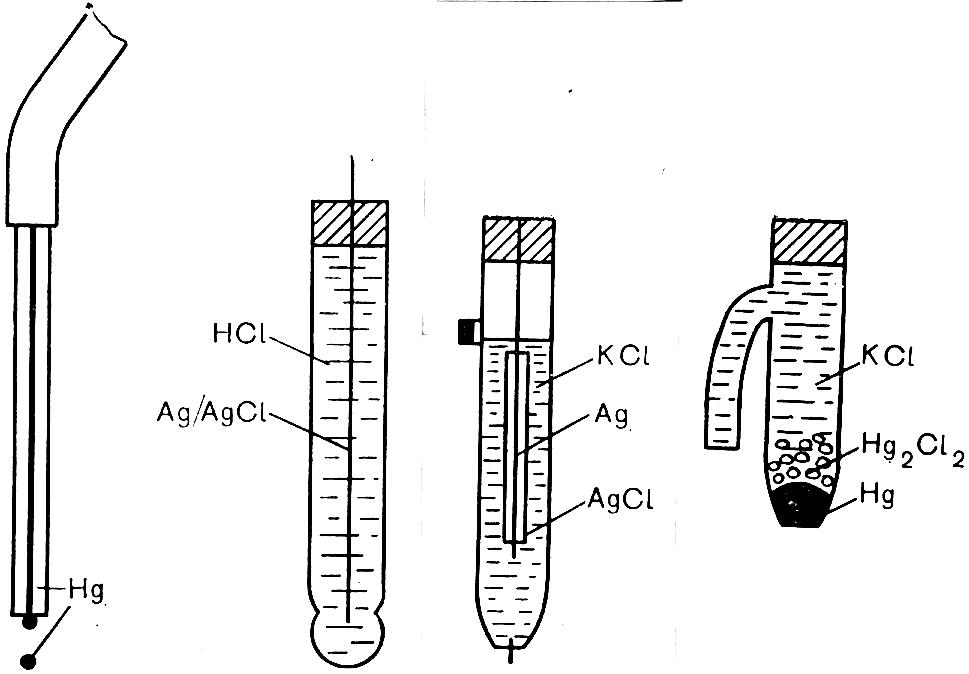
а б в г
Рис. 2.29. Електроди для електрохімічних вимірювань
а – ртутний капельний електрод; б – скляний електрод; в - хлорсрібний електрод;
г – каломельний електрод
Стандартний хлорсрібний електрод. Являє собою срібну дротинку, покриту шаром АgСІ і занурену в насичений розчин КСІ (рис.2.29). Електрод сполучається з розчином у комірці через електричний місток (розчин КСІ, що містить агар-агар, доданий для підвищення в'язкості). В електроді використана електрохімічна система Аg/АgСІ/КСІ. Потенціал електрода в насиченому розчині КСІ дорівнює Е = 0,200 В.
Стандартний каломельний електрод. Містить ( див. рис. 2.29) шар ртуті, що знаходиться в контакті із шаром Нg2СІ2 (каломелі), залитою насиченим розчином КСІ. Електрод сполучається з коміркою за допомогою електричного містка. Електрохімічна система електроду - Нg/Нg2СІ2/КСІ. Потенціал електрода в насиченому розчині КСІ дорівнює 0,243 В.
З індикаторних в електрохімічних вимірюваннях застосовують платинові електроди, що не вступають в електрохімічні реакції. Їх застосовують у кондуктометрії і потенціометрії.
Ртутний капельний електрод являє собою капіляр, сполучений з балоном із ртуттю (рис. 2.29). Ртуть надходить у капіляр і капає з нього. В процесі капання поверхня ртуті оновлюється, що забезпечує її чистоту. Ртутний електрод застосовують у вольтамперометрії.
Скляний електрод (рис.2.29) використовують у потенціометричних вимірюваннях. Він являє собою скляну трубку з тонкостінною кулькою зі спеціального скла на кінці, заповненою 0,1н. НСl. В середині поміститься хлорсрібний електрод. Під час занурення скляного електрода в аналізований розчин з концентрацією Н+ - йонів, який відрізняється від 0,1 н., на кульці виникає мембранний потенціал, пропорційний концентрації гідрогенних йонів зовні електрода.
Вимірювання електричних параметрів комірок проводять спеціальними радіотехнічними пристроями, що входять до складу приладів електрохімічних вимірювань. Електрохімічні прилади називають за типом методу - потенціометри, кондуктометри, кулонометри та інші.
