
- •Методи вимірювання параметрів навколишнього середовища
- •1. Сучасні екологічні дослідження і їх комплексний характер
- •2. Екологічний моніторинг і його елементи
- •3. Процедури і операції технологічного циклу екоаналітичного контролю забруднення навколишнього середовища
- •Питання для самоконтролю
- •Методи контролю за станом навколишнього середовища основні вимоги до методів і засобів екоаналітичного контролю
- •1. Основні вимоги до методів і засобів екоаналітичного контролю
- •1.1. Вимоги до результатів екоаналітичних робіт
- •1.2. Вимоги до засобів вимірювань
- •1.3. Вимоги до допоміжного обладнання
- •1.4. Вимоги до випробувального обладнання
- •1.5. Вимоги до засобів метрологічного забезпечення
- •1.6. Вимоги до методик виконання вимірювань
- •1.7. Вимоги до засобів пробовідбору
- •1.8. Вимоги до технічної компетентності екоаналітичних лабораторій
- •Питання для самоконтролю
- •Класифікація і основні характеристики екоаналітичних засобів
- •Питання для самоконтролю
- •Сучасні методи дослідження стану навколишнього середовища
- •1. Якісний аналіз стану довкілля
- •Питання для самоконтролю
- •2. Кількісні методи аналізу
- •Методи визначення деяких хімічних інгредієнтів у
- •2.1. Хімічні методи
- •2.2. Фізико - хімічні методи
- •Колориметрія
- •Фотоколориметрія
- •Спектрофотометрія
- •Фотоколориметри
- •Фотоколориметр кфк - 2
- •Спектрофотометри
- •Спектрофотометр сф – 46
- •Спектрофотометр сф – 14
- •Молекулярна спектроскопія
- •Рефрактометрія. Рефрактометри
- •Поляриметрія. Прилади для поляриметричних вимірювань Поляриметрія
- •Прилади для поляриметричних вимірювань
- •Стилоскопи
- •Потенціометрія
- •Потенціометри і рН-метри
- •Кондуктометрія
- •Вольтамперомерометрія (полярографія)
- •Прилади для кулонометричних вимірювань
- •Кулонометрія при постійному контрольованому потенціалі
- •Кулонометрія при постійній контрольованій силі струму (кулонометричне титрування)
- •Електролізери
- •Хроматографічний аналіз
- •Питання для самоконтролю
- •Використана література Основна
- •Допоміжна
2.1. Хімічні методи
У цих методах використовують хімічну взаємодію речовин. Проводять хімічну реакцію між речовиною і реагентом і спостерігають аналітичний ефект.
Титриметричний (об'ємний) метод аналізу ґрунтується на вимірюванні об'єму розчину реагента відомої концентрації, витраченого на взаємодію з аналізованою речовиною за умови, що речовини вступають у реакцію в стехіометричних кількостях. Концентрація визначуваного компонента 10 -1 - 10 -3 моль/л.
Титриметричнй аналіз – назва відносно нова. Хіміки старшого покоління частіше називають ці методи об'ємними. Кількість сполуки визначають у цьому випадку за об'ємом (або масою) розчину реактиву, витраченого в реакції з потрібною нам сполукою. Зміна назви методів саме й пов'язане з тим, що вимірюють не тільки об'єм, але й масу розчину. В останньому випадку використовують вагову бюретку, причому масу можна визначити з більшою точністю, ніж об'єм.
Реакцію ведуть до повного зв'язування сполуки, а кінець реакції –точку еквівалентності – знаходять, наприклад, за зміною забарвлення розчину або за іншими ознаками. Прагнучи не пропустити точку еквівалентності, реактив додають поступово, по краплях. Прикладом може служити визначення кількості кислоти титруванням її лугом у присутності індикатора, що здатний змінювати забарвдення, якщо після точки еквівалентності з'явився навіть незначний надлишок лугу. Титриметричні методи забезпечують високу точність і швидкість визначення. На відміну від гравіметричних методів, вони дозволяють послідовно визначати кілька компонентів.
Хімічні реакції, використовувані в методах титриметрії, різноманітні. Всі вони, однак, відносно швидкі й здебільшого стехіометричні. Реактиви, використовувані для титрування, повинні бути стійкими при зберіганні, до дії світла й т.д. Реакцію можна використати для титрування, якщо її кінець без особливих проблем виявляється хімічними або фізичними методами.
Досить часто застосовують, наприклад, реакції, продуктом яких є малорозчинна сполука, - осаджувальне титрування. У якості індикаторів крім давно відомих можуть служити деякі реагенти, спочатку запропоновані для фотометричного визначення відповідних елементів. Так, для визначення барію і сульфатів-йонів шляхом осадження сульфату барію успішно використовують реагент нітхромазо, що був синтезований спочатку як фотометричний реагент.
Більш важливі для аналітичної практики окислювально-відновні реакції (редокс-реакції). Крім широко застосовуваних класичних окислювально-відновних методів – перманганатометрії, броматометрії, цериметрії – пропонуються нові прийоми. Методи окислювально-відновного титрування одержали широкий розвиток.
Досить поширені комплексометричні методи титрування, в основу яких покладені реакції комплексоутворення. Відомі вони не один десяток років, але особливе значення методи ці одержали в післявоєнні роки.
Титриметричні методи прості й доступні. Піпетки, бюретки (рис. 2.5),а зараз вже й удосконалені цифрові бюретки (рис. 2.6), мірні колби, конічні колби для титрування, крапельниці - от майже весь нехитрий набір устаткування. Однак інструменталізація прийшла й сюди. Насамперед це стосується фіксації кінцевої точки титрування: фізико-хімічні й фізичні методи дозволяють робити це об'єктивно. Звичайний прийом для будь-якої лабораторії - потенціометричне титрування. Розвинені й застосовуються методи амперометричного титрування. Є й інші способи визначення кінцевої точки, включаючи найсучасніші – з використанням йонселективних електродів. Незвичайний метод – титрування з використанням радіоізотопів (радіометричне титрування). Інструменталізація має й іншу мету: автоматизувати операції. Не занадто складний титратор дозволяє проводити масові визначення з великою продуктивністю. Описані конструкції таких приладів, що випускаються різними заводами й науково-виробничими об'єднаннями вимірювальних приладів.
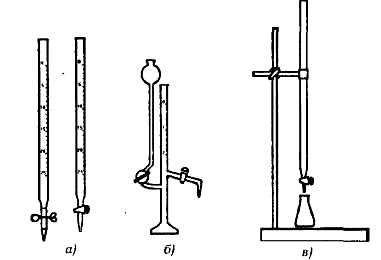
Рис. 2.5. Бюретки (а) і мікробюретка (б) для титрування в) закріплення бюретки в штатив для титрування
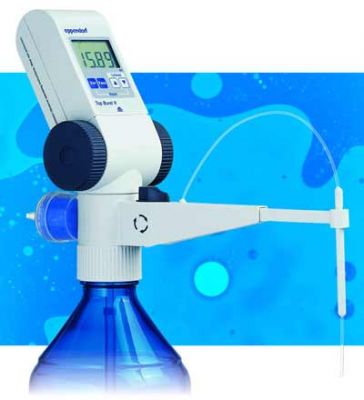
Рис. 2.6. Цифрова бюретка
Цим методом визначають загальну і карбонатну твердість води, хімічне споживання кисню (ХСК), біохімічне споживання кисню (БСК5), кислотність, лужність, вміст розчиненого кисню, концентрацію катіонів меркурію, феруму (II), аніонів С1‾, S2- тощо.
Гравіметричний (ваговий) метод ґрунтується на кількісному переведенні аналізованого компонента в малорозчинну сполуку і зважуванні продукту після виділення, промивання, висушування чи прожарювання. Цей метод не обходиться без застосування аналітичних (рис. 2.7) або технічних вагів.

Рис. 2.7. Ваги аналітичні механічні
Теорія гравіметричних методів аналізу включає вчення про утворення осадів, формулює вимоги до вагових форм і т.д. Основна операція в гравіметричному аналізі - кількісне осадження обумовленого компонента. Отриманий осад повинен бути вільним від забруднень; необхідно, щоб він легко відокремлювався від розчину, інакше кажучи – відфільтровувався й промивався. Осад повинен або сам бути сполукою постійного складу, яку неважко зважити (тобто сполукою нелеткою, негігроскопічною, інертною стосовно повітря), або переводитися в таку сполуку висушуванням або прожарюванням. Такі вимоги легко пред'явити, але важко реалізувати. Важливо усунути втрати за рахунок розчинення осаду, зменшити помилки, пов'язані із співосадженням і наступним осадженням (на готовому осаді) сторонніх компонентів. Але ж від гравіметричних методів потрібна, насамперед, висока точність. Ці методи дозволяють знизити відносну помилку визначення до 0,1%. Однак зменшити помилки можна, лише добре володіючи теорією осадження, тому дослідження в цій області тривають. Гравіметричні методи поступово поступаються місцем фізико-хімічним і фізичним методам аналізу, особливо в області досліджень. Та й у практиці хімічного аналізу частка гравіметричних методів неухильно зменшується. Істотно, однак, що процеси осадження й співосадження привертають увагу у зв'язку з їхнім використанням для поділу й концентрування елементів, причому не тільки в аналітичній хімії. Крім того, гравіметричні методи відіграють велику роль в елементному аналізі органічних сполук.
Метод застосовують при концентрації визначуваної речовини в розчині не нижче 10-2 - 10-3 моль/л.
Гравіметричним методом визначають у природних і стічних водах ферум (III) та алюміній у вигляді оксидів, хлориди – АgС1, сульфати – ВаSO4 в кислому середовищі, багато металів - у вигляді малорозчинних сполук з органічними реагентами - оксихінолінатів, литизонатів, широко використовується для дослідження руд, сплавів, органічних речовин тощо
