
- •1.1. Атомно-молекулярная теория строения вещества
- •1.2. Масса и размеры молекул
- •1.3. Броуновское движение
- •2. Газовые законы. Идеальный и реальный газы
- •2.1. Законы Бойля-Мариотта, Гей-Люссака, Шарля
- •2.2. Уравнение состояния идеального газа
- •2.3. Плотность газов
- •2.4. Основное уравнение молекулярно-кинетической теории газов
- •2.5. Постоянная Больцмана
- •3.1. Длина свободного пробега молекул
- •3.2. Скорость газовых молекул
- •3.3. Распределение Максвелла
- •4.1. Предмет термодинамики. Постулаты термодинамики
- •4.2. Температурные шкалы. Абсолютная температура
- •4.3. Температура в молекулярно-кинетической теории
- •4.3. Температура в молекулярно-кинетической теории
- •4.4. Внутренняя энергия. Работа. Теплота
- •4.5. Первое начало термодинамики.Понятие теплоемкости
- •4.6. Применение первого начала термодинамики к описанию изопроцессов в идеальном газе
- •4.7. Первое начало термодинамики как принцип эквивалентности теплоты и работы
- •4.8. Невозможность вечного двигателя первого рода
- •4.9. Принципы работы тепловых машин
- •4.10. Цикл карно. Кпд тепловых двигателей
- •4.11. Обратимые и необратимые процессы
- •4.12. Второй закон термодинамики
- •4.13. Теорема карно
- •4.14. Энтропия. Неравенство клаузиуса. Математическое выражение второго начала термодинамики
- •4.15. Статистический смысл второго начала термодинамики
- •4.16. Энтропия и термодинамическая вероятность. Формула больцмана
- •4.17. Энтропия и беспорядок
- •4.18. О "тепловой смерти" вселенной
- •5.1. Кристаллическая решетка
- •5.2. Дефекты в кристаллах
- •5.3. Плавление и кристаллизация
- •5.4. Зависимость температуры плавления от давления
- •5.5. Испарение твердых тел (сублимация)
- •5.6. Механические свойства твердых тел
- •6.1. Силы взаимодействия между молекулами. Агрегатные состояния вещества
- •6.2. Особенности строения и теплового движения в жидкостях
- •6.3. Свойства жидкостей
- •6.4. Явления на границе жидкость–пар. Насыщенный пар
- •6.5. Кипение жидкости. Зависимость температуры кипения от давления
- •6.6. Равновесие двухфазного состояния жидкость-пар. Критическая температура
- •6.7. Водяной пар в атмосфере. Влажность
- •6.8. Поверхностное натяжение
- •6.9. Давление Лапласа под искривленной поверхностью жидкости
- •6.10. Капиллярные явления. Формула Жюрена
- •6.11. Смачивание и несмачивание на границе жидкость-жидкость и твердое тело-жидкость
- •6.12. Текучесть жидкости. Сверхтекучесть гелия
6.1. Силы взаимодействия между молекулами. Агрегатные состояния вещества
Характерный вид структуры, который имеет данное вещество, определяется силами взаимодействия между его молекулами. Силы взаимодействия между молекулами имеют электромагнитную природу, хотя в целом молекулы электрически нейтральны. Но заряды в атомах и молекулах могут быть расположены не вполне симметрично, а как бы раздвинуты друг относительно друга, образуя подобие электрического диполя. А если такой асимметрии нет, то она может появиться в результате взаимодействия молекул. Количественно оценить силы взаимодействия между молекулами весьма трудно, поскольку каждая молекула содержит не по одной, а помногу заряженных частиц. Ясно только, что между молекулами могут действовать как силы притяжения, так и силы отталкивания. Силы притяжения в физике условились считать отрицательными, силы отталкивания – положительными.
Как показывают теория и опыт, и силы притяжения, и силы отталкивания очень сильно зависят от расстояния между центрами взаимодействующих молекул. Приближенно можно считать, что как те, так и другие обратно пропорциональны некоторой степени расстояния между молекулами, то есть
|
(6.1) |
|
|
|
|
|
Как видно из рис. 6.1а, при некотором
значении
![]() сила
притяжения равна силе отталкивания и
результирующая сила, действующая между
молекулами, равна нулю. Следовательно,
потенциальная энергия взаимодействия
молекул при значении
должна
иметь минимальное значение
сила
притяжения равна силе отталкивания и
результирующая сила, действующая между
молекулами, равна нулю. Следовательно,
потенциальная энергия взаимодействия
молекул при значении
должна
иметь минимальное значение
![]() .
В целом зависимость потенциальной
энергии взаимодействия молекул от
расстояния между ними представлена на
рис.6.1б и имеет вид характерной
потенциальной ямы, глубина которой
определяется величиной
.
В целом зависимость потенциальной
энергии взаимодействия молекул от
расстояния между ними представлена на
рис.6.1б и имеет вид характерной
потенциальной ямы, глубина которой
определяется величиной
![]() .
Величина
наряду
с кинетической энергией хаотического
теплового движения
.
Величина
наряду
с кинетической энергией хаотического
теплового движения
![]() ,
которая пропорциональна абсолютной
температуре системы
,
которая пропорциональна абсолютной
температуре системы
![]() ,
определяет агрегатное состояние
вещества.
,
определяет агрегатное состояние
вещества.
При невысоких температурах, когда выполняется условие Umin >> kT, (глубокая потенциальная яма) вещество пребывает в твердом агрегатном состоянии. Если же потенциальная энергия взаимодействия молекул невелика (неглубокая потенциальная яма), а система находится при достаточно высокой температуре и характеризуется большой кинетической энергией теплового движения, так что выполняется условие Umin << kT, вещество находится в газообразном состоянии. В промежуточном случае, когда Umin порядка kT, вещество пребывает в жидком конденсированном состоянии.
Современная наука имеет гораздо менее отчетливое представление о строении жидкости, чем о строении газов и кристаллических тел, что объясняется большой сложностью явлений, характеризующих жидкость. По сути дела, полная и строгая теория жидкого состояния еще не создана. Сложность решения этой задачи во многом определяется особенностями строения жидкости.
Трудности рассмотрения кристаллов, обусловленные сильным взаимодействием частиц, в значительной степени компенсируются наличием упорядоченной структуры кристаллической решетки. Трудности рассмотрения газов, обусловленные разупорядоченностью положений отдельных частиц, компенсируются слабым межчастичным взаимодействием. В случае же жидкости имеют место обе указанные трудности при отсутствии в то же время соответствующих компенсирующих факторов. Дело в том, что молекулы в жидкости достаточно сильно взаимодействуют друг с другом. Однако учесть энергию этого взаимодействия при отсутствии строгого порядка в расположении молекул в жидкости оказывается весьма сложно, что в значительной степени затрудняет создание теории жидкого состояния.

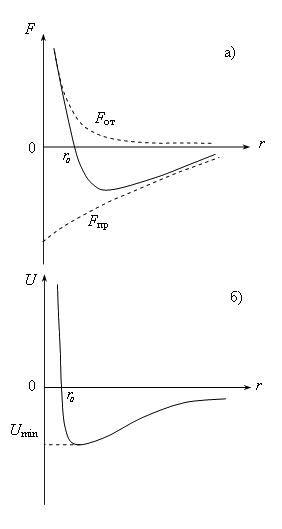 Рис.
6.1
Рис.
6.1