
- •1.1. Атомно-молекулярная теория строения вещества
- •1.2. Масса и размеры молекул
- •1.3. Броуновское движение
- •2. Газовые законы. Идеальный и реальный газы
- •2.1. Законы Бойля-Мариотта, Гей-Люссака, Шарля
- •2.2. Уравнение состояния идеального газа
- •2.3. Плотность газов
- •2.4. Основное уравнение молекулярно-кинетической теории газов
- •2.5. Постоянная Больцмана
- •3.1. Длина свободного пробега молекул
- •3.2. Скорость газовых молекул
- •3.3. Распределение Максвелла
- •4.1. Предмет термодинамики. Постулаты термодинамики
- •4.2. Температурные шкалы. Абсолютная температура
- •4.3. Температура в молекулярно-кинетической теории
- •4.3. Температура в молекулярно-кинетической теории
- •4.4. Внутренняя энергия. Работа. Теплота
- •4.5. Первое начало термодинамики.Понятие теплоемкости
- •4.6. Применение первого начала термодинамики к описанию изопроцессов в идеальном газе
- •4.7. Первое начало термодинамики как принцип эквивалентности теплоты и работы
- •4.8. Невозможность вечного двигателя первого рода
- •4.9. Принципы работы тепловых машин
- •4.10. Цикл карно. Кпд тепловых двигателей
- •4.11. Обратимые и необратимые процессы
- •4.12. Второй закон термодинамики
- •4.13. Теорема карно
- •4.14. Энтропия. Неравенство клаузиуса. Математическое выражение второго начала термодинамики
- •4.15. Статистический смысл второго начала термодинамики
- •4.16. Энтропия и термодинамическая вероятность. Формула больцмана
- •4.17. Энтропия и беспорядок
- •4.18. О "тепловой смерти" вселенной
- •5.1. Кристаллическая решетка
- •5.2. Дефекты в кристаллах
- •5.3. Плавление и кристаллизация
- •5.4. Зависимость температуры плавления от давления
- •5.5. Испарение твердых тел (сублимация)
- •5.6. Механические свойства твердых тел
- •6.1. Силы взаимодействия между молекулами. Агрегатные состояния вещества
- •6.2. Особенности строения и теплового движения в жидкостях
- •6.3. Свойства жидкостей
- •6.4. Явления на границе жидкость–пар. Насыщенный пар
- •6.5. Кипение жидкости. Зависимость температуры кипения от давления
- •6.6. Равновесие двухфазного состояния жидкость-пар. Критическая температура
- •6.7. Водяной пар в атмосфере. Влажность
- •6.8. Поверхностное натяжение
- •6.9. Давление Лапласа под искривленной поверхностью жидкости
- •6.10. Капиллярные явления. Формула Жюрена
- •6.11. Смачивание и несмачивание на границе жидкость-жидкость и твердое тело-жидкость
- •6.12. Текучесть жидкости. Сверхтекучесть гелия
2.1. Законы Бойля-Мариотта, Гей-Люссака, Шарля
Х орошо
известный закон Бойля-Мариотта был
установлен английским физиком Бойлем
в 1662 г. и независимо от него французским
ученым Мариоттом
в 1679 г.
орошо
известный закон Бойля-Мариотта был
установлен английским физиком Бойлем
в 1662 г. и независимо от него французским
ученым Мариоттом
в 1679 г.
МАРИОТТ Эдм (1620-1684) Французский физик, член Парижской Академии Наук (1666), один из ее основателей. В 1676 г. установил закон изменения объема данной массы газа от давления при постоянной температуре (закон Бойля-Мариотта). Предсказал разнообразные применения этого закона, в частности, расчет высоты местности по данным барометра. Доказал увеличение объема воды при замерзании. Обнаружил слепое пятно в глазу, исследовал цвета, в частности, цветные кольца вокруг Солнца и Луны, изучал радугу, дифракцию света.
Роберт БОЙЛЬ (1627-1691)
Б ойль
был одним из основателей и соучредителей
Королевского общества, выросшего из
кружка молодых оксфордских ученых.
Провел целый ряд новаторских химических
экспериментов, включая эксперименты
по детальному изучению свойств кислот
и оснований. По некоторым данным, первым
выдвинул гипотезу о существовании
химических элементов. Доказал, что
воздух необходим для горения и дыхания.
ойль
был одним из основателей и соучредителей
Королевского общества, выросшего из
кружка молодых оксфордских ученых.
Провел целый ряд новаторских химических
экспериментов, включая эксперименты
по детальному изучению свойств кислот
и оснований. По некоторым данным, первым
выдвинул гипотезу о существовании
химических элементов. Доказал, что
воздух необходим для горения и дыхания.
|
|
|
Процесс, происходящий при постоянной температуре, называется изотермическим. График этого процесса в координатах p – V представлен на рис. 2.1.
Закон, связывающий объем газа V и его температуру t, измеренную в градусах Цельсия, был установлен французским ученым Гей-Люссаком в 1802 г.
Жозеф-Луи Гей-Люссак (1778-1850)
Французский
химик и физик. Работы Гей-Люссака
относятся к различным областям х имии
и физики (газовые законы).
имии
и физики (газовые законы).
Для данной массы m при постоянном давлении р объем газа линейно зависит от температуры:
|
|
|
где V0 – объем газа при нуле градусов Цельсия, α – коэффициент объемного расширения, t – температура по шкале Цельсия.
График этого процесса, называемого изобарическим, представлен на рис. 2.2. Коэффициент α для всех газов равен
|
|
Закон, связывающий давление газа р и его температуру t, установлен Шарлем.
Ж ак
Александр Сезар ШАРЛЬ (1746-1823)
Французский
физик, химик, инженер и воздухоплаватель.
Заинтересовавшись воздухоплаванием,
разработал монгольфьеры современной
конструкции, подъемная сила которых
обусловлена расширением нагретого
горелкой воздуха внутри шара. Он же
одним из первых стал наполнять воздушные
шары водородом (который во много раз
легче воздуха и обеспечивает значительно
большую подъемную силу, нежели горячий
воздух), установив благодаря этому
рекорды высоты подъема (более 3 000 м) и
дальности полета (43 км). Именно занятия
воздухоплаванием заставили Шарля
заинтересоваться исследованиями свойств
газов. Закон, носящий его имя, Шарль
сформулировал в 1787 г. после ряда опытов
с кислородом, азотом, водородом и
углекислым газом.
ак
Александр Сезар ШАРЛЬ (1746-1823)
Французский
физик, химик, инженер и воздухоплаватель.
Заинтересовавшись воздухоплаванием,
разработал монгольфьеры современной
конструкции, подъемная сила которых
обусловлена расширением нагретого
горелкой воздуха внутри шара. Он же
одним из первых стал наполнять воздушные
шары водородом (который во много раз
легче воздуха и обеспечивает значительно
большую подъемную силу, нежели горячий
воздух), установив благодаря этому
рекорды высоты подъема (более 3 000 м) и
дальности полета (43 км). Именно занятия
воздухоплаванием заставили Шарля
заинтересоваться исследованиями свойств
газов. Закон, носящий его имя, Шарль
сформулировал в 1787 г. после ряда опытов
с кислородом, азотом, водородом и
углекислым газом.
|
|
|
где p0 – давление газа при нуле градусов Цельсия, β – коэффициент объемного расширения, t – температура по шкале Цельсия.
График этого процесса, называемого изохорическим, представлен на рис. 2.3. Коэффициент β для всех газов равен
|
|
В координатах Р–V изобарический и изохорический процессы представлены на рис. 2.4.
|
Если бы существовал газ, для которого не было бы отклонений от этих законов, то такой газ был бы идеальным газом.

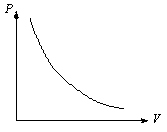 Рис.
2.1
Рис.
2.1
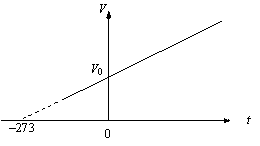 Рис.
2.2
Рис.
2.2
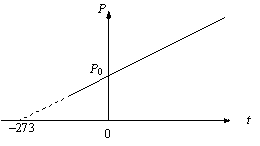 Рис.
2.3
Рис.
2.3
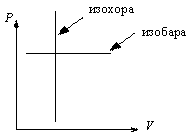 Рис.
2.4
Рис.
2.4