
- •1.1. Атомно-молекулярная теория строения вещества
- •1.2. Масса и размеры молекул
- •1.3. Броуновское движение
- •2. Газовые законы. Идеальный и реальный газы
- •2.1. Законы Бойля-Мариотта, Гей-Люссака, Шарля
- •2.2. Уравнение состояния идеального газа
- •2.3. Плотность газов
- •2.4. Основное уравнение молекулярно-кинетической теории газов
- •2.5. Постоянная Больцмана
- •3.1. Длина свободного пробега молекул
- •3.2. Скорость газовых молекул
- •3.3. Распределение Максвелла
- •4.1. Предмет термодинамики. Постулаты термодинамики
- •4.2. Температурные шкалы. Абсолютная температура
- •4.3. Температура в молекулярно-кинетической теории
- •4.3. Температура в молекулярно-кинетической теории
- •4.4. Внутренняя энергия. Работа. Теплота
- •4.5. Первое начало термодинамики.Понятие теплоемкости
- •4.6. Применение первого начала термодинамики к описанию изопроцессов в идеальном газе
- •4.7. Первое начало термодинамики как принцип эквивалентности теплоты и работы
- •4.8. Невозможность вечного двигателя первого рода
- •4.9. Принципы работы тепловых машин
- •4.10. Цикл карно. Кпд тепловых двигателей
- •4.11. Обратимые и необратимые процессы
- •4.12. Второй закон термодинамики
- •4.13. Теорема карно
- •4.14. Энтропия. Неравенство клаузиуса. Математическое выражение второго начала термодинамики
- •4.15. Статистический смысл второго начала термодинамики
- •4.16. Энтропия и термодинамическая вероятность. Формула больцмана
- •4.17. Энтропия и беспорядок
- •4.18. О "тепловой смерти" вселенной
- •5.1. Кристаллическая решетка
- •5.2. Дефекты в кристаллах
- •5.3. Плавление и кристаллизация
- •5.4. Зависимость температуры плавления от давления
- •5.5. Испарение твердых тел (сублимация)
- •5.6. Механические свойства твердых тел
- •6.1. Силы взаимодействия между молекулами. Агрегатные состояния вещества
- •6.2. Особенности строения и теплового движения в жидкостях
- •6.3. Свойства жидкостей
- •6.4. Явления на границе жидкость–пар. Насыщенный пар
- •6.5. Кипение жидкости. Зависимость температуры кипения от давления
- •6.6. Равновесие двухфазного состояния жидкость-пар. Критическая температура
- •6.7. Водяной пар в атмосфере. Влажность
- •6.8. Поверхностное натяжение
- •6.9. Давление Лапласа под искривленной поверхностью жидкости
- •6.10. Капиллярные явления. Формула Жюрена
- •6.11. Смачивание и несмачивание на границе жидкость-жидкость и твердое тело-жидкость
- •6.12. Текучесть жидкости. Сверхтекучесть гелия
5.4. Зависимость температуры плавления от давления
Подобно тому, как температура кипения зависит от давления, температура плавления и равная ей температура кристаллизации так же зависят от давления, обычно возрастая с его повышением. Это связано с тем, что возрастающее внешнее давление сближает атомы между собой, а для разрушения кристаллической решетки при плавлении атомы нужно отдалить друг от друга: при большом давлении для этого требуется большая энергия теплового движения, которой должна соответствовать и более высокая температура плавления. На рис. 5.9 показана кривая зависимости температуры плавления от давления. Сплошная кривая делит всю область P-Т на две части. Область влево от кривой соответствует твердому состоянию, а область справа от кривой – жидкому состоянию. Любая точка, лежащая на самой кривой плавления, соответствует равновесию твердой и жидкой фаз: при давлениях и температурах, соответствующих точкам на этой кривой, твердое тело и жидкость находятся в равновесии, соприкасаясь друг с другом. При этом жидкость не твердеет, а твердое тело не плавится.
|
Количественные оценки показывают, что влияние давления на температуру плавления много меньше аналогичного эффекта для кипения. Увеличение давления более чем на 107 Н/м2 понижает температуру плавления льда всего на 1 °С. Из приведенных данных видно, как наивно часто встречающееся объяснение скольжения коньков по льду понижением температуры плавления от давления. Давление на лезвие конька не приводит к снижению температуры плавления и по этой причине не может играть существенной роли для конькобежцев.
Это интересно!
5.5. Испарение твердых тел (сублимация)
Испаряться могут не только жидкости, но и твердые тела. Процесс испарения твердого тела называется сублимацией (или возгонкой). Легко наблюдать образование кристалликов йода из паров йода. Достаточно 2-3 кристаллика йода положить в пробирку и нагреть ее в пламени спиртовки. Можно видеть, что кристаллики йода не плавятся, а испаряются, образуя темно-бурые пары, которые на холодных стенках пробирки оседают в виде пятен. Рассматривая эти пятна через лупу, легко обнаружить, что они представляют собой группы кристалликов.
|
На рис. 5.10 приведена кривая зависимости давления насыщенного пара сублимирующих твердых тел от температуры. Эта кривая является линией равновесия твердой и газообразной фаз. Область слева от кривой соответствует твердому, справа от нее – газообразному состоянию.
Сублимация, так же как и плавление, связана с разрушением кристаллической решетки и требует порцию необходимой для этого энергии. Эта энергия определяет скрытую теплоту сублимации, которая равна скрытой теплоте перехода из газообразного состояния в кристаллическое. Теплота возгонки равна поэтому сумме теплоты плавления и парообразования.

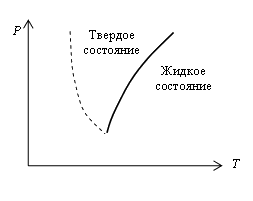 Рис.
5.9
Рис.
5.9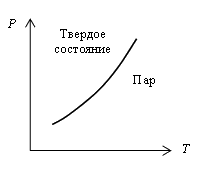 Рис.
5.10
Рис.
5.10