
- •1.1. Атомно-молекулярная теория строения вещества
- •1.2. Масса и размеры молекул
- •1.3. Броуновское движение
- •2. Газовые законы. Идеальный и реальный газы
- •2.1. Законы Бойля-Мариотта, Гей-Люссака, Шарля
- •2.2. Уравнение состояния идеального газа
- •2.3. Плотность газов
- •2.4. Основное уравнение молекулярно-кинетической теории газов
- •2.5. Постоянная Больцмана
- •3.1. Длина свободного пробега молекул
- •3.2. Скорость газовых молекул
- •3.3. Распределение Максвелла
- •4.1. Предмет термодинамики. Постулаты термодинамики
- •4.2. Температурные шкалы. Абсолютная температура
- •4.3. Температура в молекулярно-кинетической теории
- •4.3. Температура в молекулярно-кинетической теории
- •4.4. Внутренняя энергия. Работа. Теплота
- •4.5. Первое начало термодинамики.Понятие теплоемкости
- •4.6. Применение первого начала термодинамики к описанию изопроцессов в идеальном газе
- •4.7. Первое начало термодинамики как принцип эквивалентности теплоты и работы
- •4.8. Невозможность вечного двигателя первого рода
- •4.9. Принципы работы тепловых машин
- •4.10. Цикл карно. Кпд тепловых двигателей
- •4.11. Обратимые и необратимые процессы
- •4.12. Второй закон термодинамики
- •4.13. Теорема карно
- •4.14. Энтропия. Неравенство клаузиуса. Математическое выражение второго начала термодинамики
- •4.15. Статистический смысл второго начала термодинамики
- •4.16. Энтропия и термодинамическая вероятность. Формула больцмана
- •4.17. Энтропия и беспорядок
- •4.18. О "тепловой смерти" вселенной
- •5.1. Кристаллическая решетка
- •5.2. Дефекты в кристаллах
- •5.3. Плавление и кристаллизация
- •5.4. Зависимость температуры плавления от давления
- •5.5. Испарение твердых тел (сублимация)
- •5.6. Механические свойства твердых тел
- •6.1. Силы взаимодействия между молекулами. Агрегатные состояния вещества
- •6.2. Особенности строения и теплового движения в жидкостях
- •6.3. Свойства жидкостей
- •6.4. Явления на границе жидкость–пар. Насыщенный пар
- •6.5. Кипение жидкости. Зависимость температуры кипения от давления
- •6.6. Равновесие двухфазного состояния жидкость-пар. Критическая температура
- •6.7. Водяной пар в атмосфере. Влажность
- •6.8. Поверхностное натяжение
- •6.9. Давление Лапласа под искривленной поверхностью жидкости
- •6.10. Капиллярные явления. Формула Жюрена
- •6.11. Смачивание и несмачивание на границе жидкость-жидкость и твердое тело-жидкость
- •6.12. Текучесть жидкости. Сверхтекучесть гелия
4.11. Обратимые и необратимые процессы
Все происходящие в природе физические процессы делятся на два типа – обратимые и необратимые.
Пусть изолированная система в результате некоторого процесса переходит из состояния А в состояние В и затем возвращается в начальное состояние. Процесс называется обратимым, если возможно осуществить обратный переход из В в А через те же промежуточные состояния так, чтобы при этом не осталось никаких изменений в окружающих телах. Если такой обратный переход осуществить нельзя, если по окончании процесса в самой системе или окружающих телах остались какие-то изменения, то процесс является необратимым.
Любой процесс, сопровождаемый трением, является необратимым, ибо при трении часть работы всегда превращается в тепло, тепло рассеивается, в окружающих телах остается след процесса – нагревание, что делает процесс с участием трения необратимым. Идеальный механический процесс, происходящий в консервативной системе (без участия сил трения), был бы обратимым. Примером такого процесса является колебание тяжелого маятника на длинном подвесе. Из-за малого сопротивления среды амплитуда колебаний маятника практически не изменяется в течение продолжительного времени, при этом кинетическая энергия колеблющегося маятника полностью переходит в его потенциальную энергию и обратно.
|
Опыт показывает, что тепловые явления почти всегда обладают свойством необратимости. Так, например, если рядом находятся два тела, из которых одно теплее другого, то их температуры постепенно выравниваются, то есть тепло "само собой" перетекает от более теплого тела к более холодному. Однако обратный переход теплоты от более холодного тела к нагретому, который может быть осуществлен в холодильной машине, не идет "сам собой". Для осуществления такого процесса требуется затрата работы еще какого-либо тела, что приводит к изменению состояния этого тела. Следовательно, условия обратимости не выполняются.
Кусочек сахара, помещенный в горячий чай, растворяется в нем, но никогда не бывает, чтобы из горячего чая, в котором уже растворен кусочек сахара, этот последний выделился и вновь собрался в виде кусочка. Конечно, получить сахар, выпарив его из раствора, можно. Но этот процесс сопровождается изменениями в окружающих телах, что свидетельствует о необратимости процесса растворения. Необратимым является и процесс диффузии. И вообще примеров необратимых процессов можно привести сколь угодно много. По сути, любой процесс, протекающий в природе в реальных условиях, является необратимым.
Итак, в природе существуют два вида принципиально различных процессов – обратимые и необратимые. М. Планк сказал однажды, что различие между обратимыми и необратимыми процессами лежит гораздо глубже, чем, например, между процессами механическими и электрическими, поэтому его с большим основанием, чем любой другой признак, следовало бы выбрать в качестве первейшего принципа при рассмотрении физических явлений.
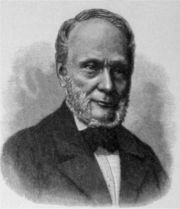
Клаузиус Рудольф Юлиус Эммануэль (1822-1888) – немецкий физик, один из основателей термодинамики и молекулярно-кинетической теории теплоты, иностранный член-корреспондент Петербургской АН (1878). Клаузиус (одновременно с У. Томсоном) дал первую формулировку второго начала термодинамики (1850), ввел понятие энтропии (1865) и длины свободного пробега и обосновал уравнение Клапейрона-Клаузиуса. Разработал теорию поляризации диэлектриков (формула Клаузиуса-Моссотти) и поддерживал гипотезу "тепловой смерти Вселенной").

Томсон Уильям (1824-1927). С 1892 года за научные заслуги барон Кельвин, английский физик, член (1851) и президент (1890-1895) Лондонского Королевского общества, почетный член Петербургской АН (1896). Труды по многим разделам физики, в том числе дал одну из формулировок второго начала термодинамики, предложил термодинамическую шкалу температур (шкала Кельвина). Экспериментально открыл эффект Джоуля-Томсона.

 Рис.
4.15
Рис.
4.15