
Т
 ЕМА:
ФИЗИОЛОГИЯ ВОЗБУЖДЕНИЯ И ВОЗБУДИМЫХ
ТКАНЕЙ.
ЕМА:
ФИЗИОЛОГИЯ ВОЗБУЖДЕНИЯ И ВОЗБУДИМЫХ
ТКАНЕЙ.
Занятие 1. Биоэлектрические явления в живых тканях.
Вопросы для самоподготовки:
Биологический смысл раздражимости. Возбуждение и его физиологические основы.
Наблюдение биоэлектрических явлений.
Современные представления о строении биологических мембран. Мембранная теория возбуждения.
Роль мембранных транспортных систем в обеспечении электрической активности клетки.
Электрические и физиологические проявления возбуждения. Ионные основы возникновения потенциала покоя.
Изменения электрического состояния клетки при возбуждении. Потенциал действия.
Базовая информация.
Неотъемлемым свойством организмов и всех живых систем является раздражимость - способность воспринимать внешние или внутренние раздражители (воздействия) и адекватно на них реагировать. Раздражителем живой клетки может быть любое изменение внешней или внутренней среды, если оно достаточно велико, возникло достаточно быстро и продолжается достаточно долго. Энергией для реакции клетки служит не энергия раздражителя, а энергия, образующаяся в результате метаболизма в самой биологической системе, а сила и форма реакции клетки не определяется силой и формой внешнего воздействия.
У живых организмов раздражимость сопровождается комплексом изменений, выражающихся в сдвигах обмена веществ, электрического потенциала на мембранах клеток, физико-химических параметров в цитоплазме клеток, в двигательных реакциях, а высокоорганизованным животным присущи изменения в их поведении.
У животных, не имеющих нервной системы, одноклеточных организмов и некоторых клеток многоклеточных организмов реакции на раздражение выражаются, в частности, в форме двигательных реакций - таксисов, пространственных перемещений. В зависимости от характера раздражения выделяют: фототаксис, хемотаксис, термотаксис, геотаксис и т.д. У фотосинтезирующих организмов обычно ярко выражен положительный фототаксис (перемещение в зону, наиболее освещенную), гетеротрофным организмам чаще всего свойственен отрицательный фототаксис (избегание освещенных зон). Благодаря хемотаксису, фагоциты крови скапливаются вокруг, например, проникших в организм бактерий и осуществляют свою функцию - фагоцитоз ("пожирание") бактерий.
Растения сравнительно с животными характеризуются малой подвижностью. Большинство движений у растений возникает как ответные реакции на раздражение светом, температурой, гравитацией, химическими факторами. Активные движения у растений наблюдаются двух типов: ростовые и сократительные. Первые движения более медленные, а вторые более быстрые. Ростовые движения связаны с влиянием на растение фактора, действующего в одном направлении. Это вызывает односторонний рост, а как следствие этого возникает изгиб. Такие изгибы органов растения получили название тропизмов. Любой тропизм может быть положительным или отрицательным. Положительным он называется тогда, когда растение изгибается по направлению к раздражителю, а отрицательным, если растение изгибается в противоположную от раздражителя сторону.
К сократительным движениям у растений можно отнести быстрые движения листьев у мимозы, кислицы, насекомоядных растений (например, росянки) при прикосновении к ним - настии. У мимозы черешки перистых листьев и отдельные листочки имеют особые участки с особыми клетками. При раздражении (прикосновении, толчке, тряске) клетки быстро теряют воду, внутриклеточное давление резко падает, и листочки складываются. В настоящее время высказываются предположения, что механизм быстрых движений связан также с наличием особых сократительных белков.
У многоклеточных животных нервная и мышечная системы обеспечивают ответные двигательные реакции; развиваются формы опосредованной реактивной связи с раздражителем через высшую нервную деятельность и сознание. Благодаря раздражимости достигается уравновешивание организмов с внешней средой: организмы адекватно реагируют на изменения условий окружающей их среды изменениями в функционировании соответствующих элементов биологической системы и самой системы в целом.
Многообразие и сложность ответных реакций многоклеточных животных связана с тем, что в процессе эволюции происходила постепенная дифференциация тканей, осуществляющих приспособительную деятельность организма. Раздражимость этих тканей достигла наивысшего развития и трансформировалась в новое свойство – возбудимость, которая является частным случаем наиболее общего свойства всех клеток — раздражимости. Под возбудимостью понимают способность ткани отвечать на раздражение специализированной реакцией - возбуждением.
Возбуждение - это сложный биологический процесс, который характеризуется специфическим временным изменением заряда мембраны клеток способным распространяться по их поверхности и проявляющийся специализированной реакцией ткани (сокращение секреция и т. д.). Возбуждение – активный процесс, т.е. он может продолжаться и после прекращения действия раздражителя. Ткани способные к возбуждению – объединяют в понятие «возбудимые ткани», их три:
нервные клетки (возбуждение проявляется генерацией электрического импульса);
мышечные клетки (возбуждение проявляется сокращением);
секреторные клетки (возбуждение проявляется выбросом в межклеточное пространство биологически активных веществ);
Клетки возбудимых тканей могут находиться в двух дискретных состояниях: состоянии покоя (готовность к реагированию на внешнее воздействие, совершение внутренней работы) и состоянии возбуждения (активное выполнение специфических функций, совершение внешней работы).
В состоянии покоя мембрана возбудимой клетки поляризована, т.е. имеется постоянная разность потенциалов между внутренней и наружной поверхностью клеточной мембраны, которую называют мембранный потенциал (МП). Значение МП клетки в состоянии покоя называют потенциалом покоя (ПП), его можно измерять, разместив один электрод внутри, а другой снаружи клетки (рис.1 А), В состоянии покоя внутренняя сторона мембраны заряжена отрицательно относительно наружной.
В состоянии возбуждения происходит активное изменение мембранного потенциала. Уменьшение МП относительно его нормального уровня (ПП) называют деполяризацией, а увеличение - гиперполяризацией. Под реполяризацией понимают восстановление исходного уровня МП после его изменения (см. рис. 2.1 Б).
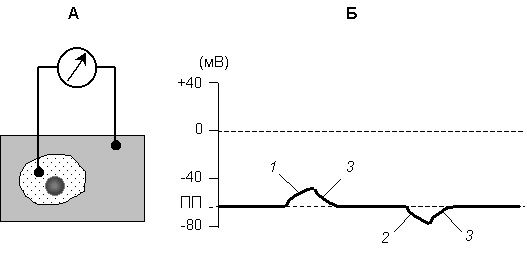
Рис. 1. Схема регистрации мембранного потенциала клетки (А); мембранный потенциал клетки в состоянии покоя и его возможные изменения (Б).
1 – деполяризация, 2 – гиперполяризация, 3 – реполяризация.
Наблюдение биоэлектрических явлений. Мембранная теория возбуждения.
В конце XVIII в. (1786) профессор анатомии Болонского университета Луиджи Гальвани провел ряд опытов, положивших начало целенаправленным исследованиям биоэлектрических явлений. Он обратил внимание на сокращение мышц препарата задних лапок лягушки, подвешенного на медном крючке, при прикосновении лапок к железным перилам балкона. На основании этих наблюдений Л. Гальвани пришел к выводу, что сокращение мышц лапок вызвано воздействием на них электричества, источником которого выступают «животные ткани» — мышцы и нервы. Этот опыт в настоящее время известен как первый опыт Гальвани. Физик и физиолог А. Вольта — оспорил это заключение, повторив опыт Гальвани, он пришел к заключению, что они не доказывают наличия "животного электричества". По его мнению, причиной сокращения мышц был электрический ток, возникающий в области контакта двух разнородных металлов: меди и железа (гальваническая пара) — с тканями лягушки.
В ответ на эти возражения Гальвани усовершенствовал опыт, исключив из него металлы, нерв нервно-мышечного препарата набрасывался на специально поврежденную мышцу стеклянным крючком так, чтобы он касался поврежденного и неповрежденного ее участков. В этом случае мышца также сокращалась. Этот опыт известен как второй опыт Гальвани, или опыт без металлов. В этом опыте были получены абсолютные доказательства существования «животного электричества». В 1797 открытие Л. Гальвани подтвердил немецкий натуралист А. Гумбольдт.
Разность электрических потенциалов между поврежденной и неповрежденной частями мышцы обнаружил в 1837 итальянский физик и физиолог Карло Маттеуччи.
Маттеучи произвел также опыт, известный под названием опыта вторичного сокращения: при накладывании на сокращающуюся мышцу нерва второго нервно-мышечного препарата его мышца тоже начинает сокращаться. Результат опыта Маттеучи объясняется тем, что возникающий в мышце при ее возбуждении потенциал действия оказывается достаточно сильным, чтобы вызвать возбуждение другого нерва и мышцы.
В 1848 г. германский физиолог Э. Дюбуа-Реймон, используя более совершенные средства экспериментальной техники, подтвердил существование разности потенциалов между поврежденным и неповрежденным участками невозбужденной мышцы или нерва, а также то, что «ток повреждения» уменьшается при возбуждении. Это «отрицательное колебание» в последствии было названо «потенциалом действия». Работы Э. Дюбуа-Реймона положили начало современной электрофизиологии.
Было разработано несколько теорий возникновения и поддержания мембранного потенциала покоя. Первой работой, положившей начало целенаправленному объяснению причин и механизмов возникновения и существования электрических явлений в живых тканях, следует считать работу В. Ю. Чаговца, выполненную в 1896 г. в лабораториях российских физиологов И.М. Сеченова и И.Р. Тарханова в Военно-медицинской академии и Санкт-Петербургском университете. В дальнейшем Ю.Бернштейном (1902) была сформулирована мембранно-ионная концепция электрогенеза живых тканей, а в 1908 г. была опубликована модель биоэлектрогенеза В. Нернста.
Результатом развития этих представлений стала мембранно-ионная теория, которую сформулировали и экспериментально обосновали в 1949-52 гг. Ходжкин, Хаксли, Катц. Согласно этой теории мембранный потенциал покоя и его изменения при возбуждении обусловлены неодинаковой концентрацией ионов натрия, калия, кальция, хлора внутри клетки и во внеклеточной жидкости, а также неодинаковой проницаемостью для этих ионов плазматической мембраны клетки. Теория, предложенная Ходжкиным и Хаксли, предлагает исчерпывающе полное биофизическое описание потенциала действия, хотя методы исследования молекулярных механизмов нервного импульса (мембранных структур, контролирующих перемещение ионов) стали доступными только в 80-х гг.
Ходжкин и Хаксли получили Нобелевскую премию по физиологии и медицине 1963 г. «за открытия, касающиеся ионных механизмов, участвующих в возбуждении и торможении в периферическом и центральном участках мембраны нервной клетки». Они разделили премию вместе с Джоном С. Эклсом.
Жидкостно-мозаичная модель биологических мембран
В 1972 г. Джонатан Сингер и Гарт Николсон предложили жидкостно-мозаичную модель, объясняющую в общих чертах организацию биологических мембран. Согласно этой модели, мембраны представляют собой двумерные растворы определенным образом ориентированных фосфолипидов и глобулярных белков которые пронизывают мембрану насквозь (интегральные белки) или погружены в ее толщу (периферические белки).
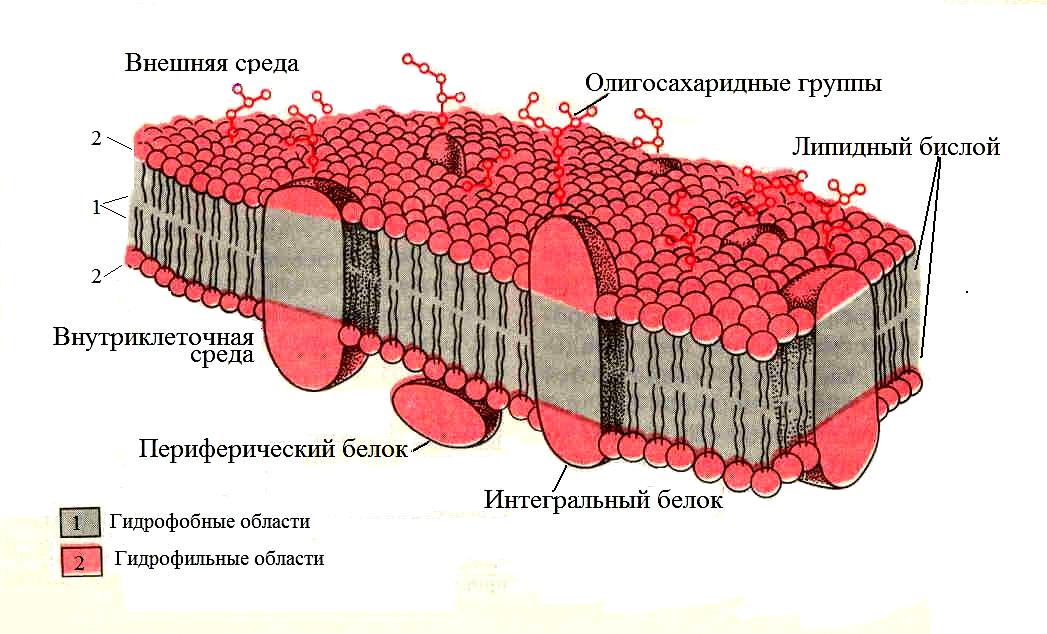
Рис. 2. Жидкостно-мозаичная модель строения плазматической мембраны.
Большая часть мембранных фосфолипидов и гликолипидов представлена в виде бислоя который играет двоякую роль. Во-первых, небольшая часть мембранных липидов специфически связана с определенными мембранными белками и, вероятно, необходима для их функционирования. Во-вторых, будучи гидрофобными, мембранные фосфолипиды являются барьером проницаемости, обеспечивая одну из базовых функций клетки – барьерную (защитную), благодаря которой внутреннее содержимое клетки надежно отделено от внешней среды.
Молекулы белков встроены (интеркалированы) в фосфолипидный матрикс клеточной мембраны. Все мембранные белки свободно перемещаются в липидном матриксе в латеральном направлении, но не могут перемещаться в поперечном направлении, т.е. от одной поверхности мембраны к другой.
Благодаря высокой химической активности, специфическими белками выполняются многие важные функции мембран связанные с распознаванием сигналов, ферментативной активностью, преобразованием энергии, переносом веществ. Белки, прикрепленные к поверхности клеточной мембраны (в основном к внутренней ее части), называют периферическими, они, как правило, являются ферментами (ацетилхолинестераза, фосфатазы, аденилатциклаза, протеинкиназы). Некоторые интегральные белки также выполняют функцию ферментов, например АТФаза. Рецепторами и антигенами мембраны могут быть как интегральные, так и периферические белки. Белки, примыкающие к мембране с внутренней стороны, являются также составной частью цитоскелета, который обеспечивает дополнительную прочность клеточной мембране и ее эластичность.
Важнейшей функцией интегральных белков является перенос веществ через клеточную мембрану. (транспортная функция) – процесс, имеющий фундаментальное значение для всех живых клеток, так как обеспечивает обмен веществ и поддержание гомеостаза. Кроме того, за счет переноса заряженных частиц – ионов - работой транспортных систем поддерживается электрическая активность плазматической мембраны, лежащая в основе раздражимости и возбудимости.
Основную роль в возникновении и поддержании электрических состояний мембраны играют следующие ее транспортные системы: первично активного транспорта – ионные насосы (помпы), - работа которых обеспечивает формирование и восстановление заряда мембраны, и вторично активного транспорта – ионные каналы, - которые играют основную роль в изменении заряда мембраны при действии раздражителя.
Насосы представляют собой белковые молекулы, обладающие свойствами переносчика и АТФ-азной активностью. Обычно указывают на существование трех ионных насосов: натрий-калиевого, кальциевого и водородного, есть основание предполагать наличие и хлорного насоса. Насосы локализуются на клеточных мембранах или мембранах органелл клеток.
В результате работы ионных насосов плазматической мембраны создаются и поддерживаются трансмембранные ионные градиенты, определяющие заряд мембраны – мембранный потенциал:
концентрация Na+, Ca2+, Cl– внутри клетки ниже, чем снаружи (в межклеточной жидкости)
концентрация K+ внутри клетки выше, чем снаружи.
Натрий-калиевый насос (Na/K-АТФаза) — это интегральный белок клеточной мембраны, обладающий, как и все другие насосы, свойствами фермента, т. е. сам переносчик обеспечивает расщепление АТФ и освобождение энергии, которую он же сам и использует. Более трети энергии АТФ, потребляемой клеткой в состоянии покоя, расходуется на перенос только ионов Na+ и К+. Этот насос имеется в мембранах всех клеток и создает характерный признак живого — градиент концентрации Na+ и К+ внутри и вне клетки, что обеспечивает формирование мембранного потенциала и вторичный транспорт веществ. Главными активаторами насоса являются гормоны (альдостерон, тироксин), ингибирует насос недостаток энергии (кислородное голодание), его специфическими блокаторами являются строфантины, особенно уабаин. Работа натриевого насоса после удаления К+ из среды сильно нарушается.
Кальциевый насос локализуется в эндоплазматическом ретикулуме и в клеточной мембране, он обеспечивает транспорт Са2+. Насос строго контролирует содержание Са2+ в клетке, поскольку изменение содержания Са2+ в ней нарушает ее функционирование. Насос переносит Са2+ либо во внеклеточную среду (в гладких мышцах), либо в цистерны ретикулума (в поперечно-полосатых мышцах) и митохондрии (внутриклеточное депо Са2+).
Протонный насос работает в митохондриях .
Хлорный насос работает, по-видимому, подобно всем другим помпам и играет главную роль в процессах торможения ЦНС.
Механизм работы ионных насосов заключается в следующем. Na+/K+-насос переносит за один цикл 3Na+ из клетки и 2К+ в клетку . Это осуществляется в результате конформации (изменения третичной структуры) молекулы белка в форму при которой его активный участок способен связывать либо Na+ (форма Е1), либо К+ (форма Е2). При конформации Е1 активная часть белка обращена внутрь клетки где и связывает Na+, вследствие чего активируется его АТФ-аза, в результате белок превращается в форму Е2 и активный участок поворачивается наружу клеточной мембраны. Теперь он теряет сродство к Na+, который отщепляется, а приобретает сродство к иону К+ и соединяется с ним. Это снова ведет к изменению конформации переносчика: форма Е2 переходит в форму Е1 , а активный участок белка опять поворачивается внутрь клетки. При этом он теряет сродство к иону К+, который отщепляется, а белок приобретает снова сродство к иону Na+, т.е. цикл повторяется.
Насос является электрогенным, поскольку за один цикл выводится из клетки три иона Na+, а возвращаются в клетку два иона К+. Энергия расходуется только на перенос Na+. На Обеспечение одного цикла работы Na/K-помпы расходуется одна молекула АТФ.
Подобным образом работают и Са-АТФазы эндоплазматического ретикулума, а также клеточной мембраны, с тем лишь различием, что переносятся только ионы Са2+ и в одном направлении: из гиалоплазмы в эндоплазматический ретикулум либо наружу клетки.
Ионные каналы – интегральные белки, которые обеспечивают пассивный транспорт ионов по градиенту концентрации. Энергией для транспорта служит разность концентрация ионов по обе стороны мембраны (трансмембранный ионный градиент), который создается работой мембранных насосов.
Наличие ионных каналов впервые было доказано для мембран нервной ткани. Структурно каналы представляет собой, как бы, «поры» которые имеют устье и селективный фильтр, а управляемые каналы — и воротный механизм. Каналы способны пропускать ионы через мембрану с огромной скоростью, через один ионный канал может проходить 107- 108 ионов в секунду. Количество каналов на единицу площади мембраны так же очень велико, поэтому суммарный заряд переносимых ионов может быть относительно большим. Движение зараженных ионов, создает ток, текущий через плазматическую мембрану клетки. Изменение величины и направления этого тока, приводит к изменению заряда самой плазматической мембраны и воспринимается клеткой как изменение окружающей среды. Этот процесс и лежит в основе электрической природы раздражимости.
Классификация ионных каналов проводится по нескольким признакам.
По возможности управления их функцией различают управляемые и неуправляемые каналы (каналы
утечки ионов). Через неуправляемые каналы ионы перемещаются постоянно, но медленно. Управляемые каналы имеют управляемый воротный механизм, поэтому ионы через них могут проходить только при открытых воротах.
По скорости движения ионов каналы могут быть быстрыми и медленными.
Различают несколько видов управляемых ионные каналов в зависимости от активирующего или
инактивирующего их стимула. В обеспечении электрической активности клетки основную роль играют потенциал- и хемочувствительные каналы.
а) потенциалчувствительные (электроуправляемые) – их воротный механизм чувствителен к заряду мембраны (мембранному потенциалу). Состояние воротного механизма, состоящего из активационных и инактивационных ворот, определяет три состояния такого канала: «закрытый», «открытый» и «инактивированный».
В покое активационные ворота закрыты, инактивационные ворота открыты, канал находится в состоянии «закрытый». При снижении мембранного потенциала (деполяризации) на определенную (пороговую) величину активационные ворота открываются, и начинается транспорт ионов через канал (канал «открыт»). Это приводит к дальнейшей деполяризации мембраны, и как следствие к закрытию инактивационных ворот и прекращению транспорта ионов (канал «инактивирован»). «Инактивированный» канал, в отличие от «закрытого», не может быть открыт ни при каких условиях. Восстановление исходной величины мембранного потенциала (реполяризация) переводит канал в исходное состояние - «закрытый», и цикл его активности может быть повторен.
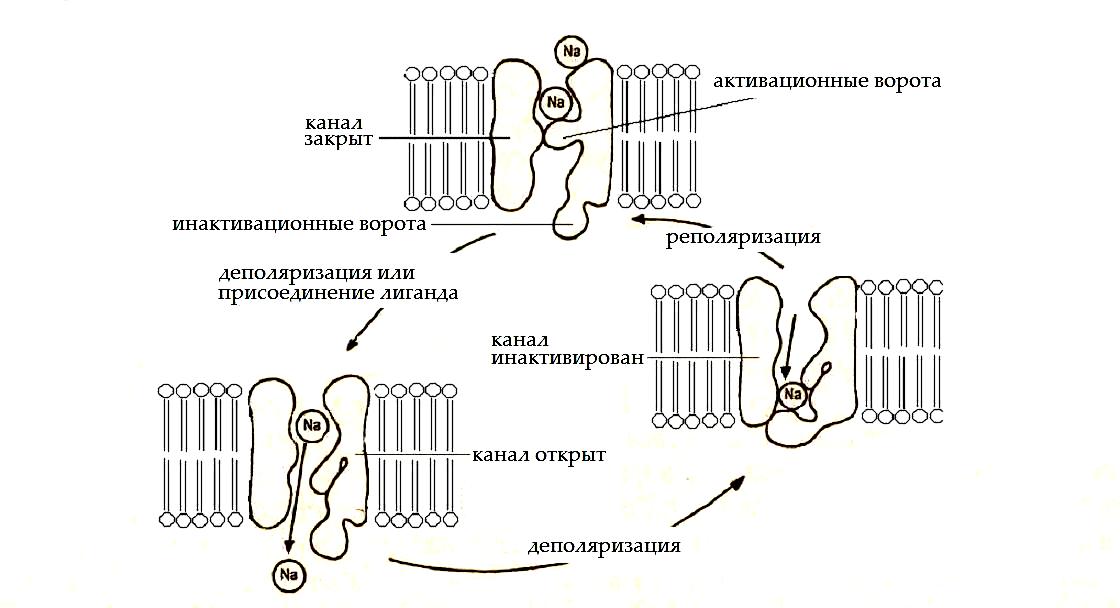
Рис.3. Состояния селективного ионного канала и условия перехода между ними.
б) хемо-чувствительные (хемо-управляемые) – воротный механизм этих каналов структурно связан с белком-рецептором чувствительным к определенным химическим веществам. При взаимодействии медиатора (лиганда) с рецепторами, расположенными на поверхности клеточной мембраны, в результате конформационных изменений, происходит открытие ворот этих каналов, поэтому их называют также рецепторуправляемыми каналами. Разрушение связи между рецептором и медиатором приводит к закрытию канала.
Следует отметить, что по современным представлениям, большинство каналов имеет смешанное регулирование: от заряда мембраны зависит вероятность открытия канала, а от химического регулятора - время нахождения в открытом состоянии.
Можно выделить также:
в) механочувствительные – эти каналы активируются и инактивируются сдавливанием и растяжением.
г) кальций-чувствительные – это один из примеров хемо-чувствительных каналов которые активируются кальцием, причем Са2+ может активировать как собственные каналы, например Са-каналы саркоплазматического ретикулума, так и каналы других ионов, например каналы ионов К+.
д) каналы, чувствительные ко вторым посредникам – расположены во внутриклеточных мембранах, они изучены недостаточно, так же как и кальций-чувствительные каналы.
Плазматическая мембраны возбудимых клеток может содержать потенциало-, хемо-, механо- и кальцийчувствительные каналы.
Каналы одного и того же вида могут влиять на активность друг на друга. Так, открытие одних электроуправляемых каналов способствует активации рядом расположенных электрочувствительных каналов, в то время как открытие одного хемо- или механочувствительного канала практически не влияют на состояние соседних таких же каналов. Частичная деполяризация клеточной мембраны за счет активации хемо- или механочувствительных каналов может привести к активации потенциалчувствительных каналов.
В зависимости от селективности различают ионоселективные каналы, пропускающие только один
ион, и каналы, не обладающие селективностью. Имеются Na-, K-, Са-,С1- и Na/Ca-селективные каналы. Наиболее высока степень селективности потенциалчувствительных (потенциалзависимых) каналов, несколько ниже она у хемочувствительных (рецепторзависимых) каналов. Механочувствительные каналы являются вообще неселективными.
Один и тот же ион может транспортироваться несколькими видами каналов. Наиболее важными из них для формирования биопотенциалов являются следующие.
Каналы для К+:
а) неуправляемые каналы покоя (каналы утечки) через которые К+ постоянно выходит из клетки, что является главным фактором в формировании мембранного потенциала (потенциала покоя);
б) потенциалчувствительные, управляемые К-каналы;
в) К-каналы, активируемые Са2+;
г) каналы, активируемые и другими ионами и веществами, например ацетилхолином, что обеспечивает, например, гиперполяризацию миоцитов сердца.
Каналы для Na+ :
а) потенциалчувствительные быстрые Na-каналы — быстро активирующиеся при уменьшении мембранного потенциала, обеспечивают вход Na+ в клетку во время ее возбуждения;
б) рецепторуправляемые Na-каналы, активируемые ацетилхолином в нервно-мышечном синапсе, глутаматом — в синапсах нейронов ЦНС;
в) медленные неуправляемые Na-каналы — каналы утечки, через которые Na+ постоянно диффундирует в клетку и переносит с собой другие молекулы, например глюкозу, аминокислоты, молекулы-переносчики. Таким образом, Na-каналы утечки обеспечивают вторичный транспорт веществ и участие Na в формировании мембранного потенциала.
Каналы для Са2+:
а) медленные кальциевые потенциалчувствительные каналы (новое название:L-типа), медленно активирующиеся при деполяризации клеточной мембраны, обусловливают медленный входСа2+ в клетку и медленный кальциевый потенциал, например, у кардиомиоцитов. Имеются в исчерченных и гладких мышцах, в нейронах ЦНС;
б) быстрые кальциевые потенциалчувствительные каналы саркоплазматического ретикулума обеспечивают выход Са2+ в гиалоплазму и электромеханическое сопряжение.
Каналы для Cl- имеются в скелетных и сердечных миоцитах, эритроцитах, в небольшом количестве в нейронах и сконцентрированы в синапсах. Потенциалуправляемые С1-каналы имеются в кардиомиоцитах, рецепторуправляемые — в синапсах ЦНС и активируются тормозными медиаторами ГАМ К и глицином.
Электрические и физиологические проявления возбуждения
В состоянии покоя мембрана возбудимой клетки поляризована, т.е. имеется постоянная разность потенциалов между внутренней и наружной поверхностью клеточной мембраны, причем наружная сторона заряжена положительно по отношению к внутренней. Эту разность потенциалов называют потенциалом покоя. Возникновение потенциала покоя – результат работы мембранных транспортных систем.
Ионные основы возникновения потенциала покоя. Физиологической основой потенциала покоя является неравномерное распределение различных ионов (прежде всего К+) между вне- и внутриклеточным пространством, создаваемое непрерывной работой Na+/К+ - АТФ-азы. Закачивая в клетку ионы К+, и удаляя из клетки ионы Na+, (в соотношении 3К+/2Na+), она создает мощнейший химический градиент этих ионов (10-15 раз) между вне- и внутриклеточным пространствами. Сам по себе, этот градиент не приводит к возникновению существенного заряда на мембране, т.к. заряд переносимых ионов одинаков, а электрогенность самой АТФ-азы невелика. Однако, возникающий градиент концентрации калия столь велик, что диффузия этого иона из клетки становится достаточно значимой. Кроме того, большая часть его «стравливается» через неспособные к инактивации К+ - каналы (каналы утечки).
Мембранный потенциал, возникающий в результате утечки К+, называют “равновесным калиевым потенциалом” (ЕК). Его можно рассчитать по формуле Нернста:
![]()
где R – универсальная газовая постоянная,
Т – температура (по Кельвину),
F – число Фарадея,
[К+]нар – концентрация ионов К+ снаружи клетки,
[К+]вн – концентрация ионов К+ внутри клетки.
Вынос дополнительного, положительного заряда наружу приводит к тому, что, наружная сторона плазматической мембраны заряжается положительно относительно своей внутренней стороны, т.е. возникает потенциал – потенциал покоя. Величина его близка к равновесному калиевому, но не равна ему. Эта разница объясняется тем, что свой вклад в формирование ПП вносят:
во-первых - поступление в клетку Na+ и Cl– через неселективные ионные каналы; при этом поступление в клетку Cl– дополнительно гиперполяризует мембрану, а поступление Na+ - дополнительно деполяризует ее; вклад этих ионов в формирование ПП невелик, т.к. проницаемость неселективных каналов для Cl– и Na+ в 2,5 и 25 раза ниже, чем для К+;
во-вторых – прямой электрогенный эффект Na+/К+ ионного насоса, возникающий в том случае, если ионный насос работает асимметрично (количество переносимых в клетку ионов K+ не равно количеству выносимых из клетки ионов Na+).
Поле, создаваемое избытком положительных ионов снаружи клетки формирует электрический градиент, который препятствует неограниченному выходу ионов К+ из клетки. Таким образом возникает динамическое равновесие способствующее непрерывному поддержанию определенной величины потенциала покоя.
Любая живая клетка поддерживает на мембране определенной величины потенциал. Его величина колеблется в значительных пределах, у возбудимых клеток его величина составляет обычно 60 - 90 мВ, у других тканей не превышает 10 мВ. Различные внешние воздействия, способные изменять ионную проницаемость мембраны, вызывают изменения величины ПП. Форма и последствия этих изменений зависят, при прочих равных условиях, от характеристик раздражителя.
Универсальным раздражителем для мембран возбудимых клеток является электрический ток, а все формы изменения величины ПП наблюдаются при внутриклеточном способе раздражения (с помощью электродов, один из которых введен внутрь клетки, а другой расположен на ее поверхности (см. рис.1)).
Эти формы представлены на рис 4.
При действии слабых импульсов постоянного электрического тока на мембране клетки под приложенными электродами развивается электротонический потенциал (ЭП) – сдвиг мембранного потенциала в сторону соответствующую полярности электрода. ЭП это пассивная реакция клетки на электрический раздражитель. Никакой физиологической реакцией клетки не проявляется, состояние ионных каналов и транспорт ионов при этом не изменяется, т.к. силы раздражителя не хватает для открытия воротного механизма канала, Поэтому ЭП не является возбуждением.
При действии более сильного тока возникает и более сильный сдвиг мембранного потенциала – локальный ответ. Локальный ответ (ЛО) – активная реакция клетки на электрический раздражитель, при котором происходит открытие потенциалчувствительных ионных каналов. Однако, транспорт ионов при этом изменяется незначительно, ток текущий через открытые каналы невелик и не способен повлиять на воротный механизм каналов находящихся вне поля действия электродов. Локальный ответ не проявляется заметной физиологической реакцией клетки, его называют местным возбуждением, т.к. это возбуждение не распространяется по мембранам возбудимых клеток. Такая форма электрической активности является основной для большинства клеток не способных к возбуждению, и реагирующих изменением мембранного потенциала только в месте действия раздражителя.
П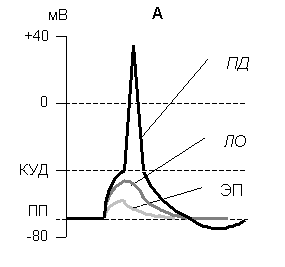 ри
достижении силы раздражителя определенной
(пороговой) величины происходит быстрое,
активное изменение потенциала покоя -
потенциал действия (ПД), - быстрое
колебание (спайк) мембранного потенциала,
возникающее при возбуждении нервных,
мышечных, некоторых железистых и
растительных клеток; электрический
сигнал, обеспечивающий быструю передачу
информации в организме. Потенциал
действия лежит в основе процесса
возбуждения. Он характеризуется
тем, что значение потенциала покоя
клетки очень быстро уменьшается до 0
(деполяризация), и даже приобретает
положительное значение (+20…+30 мВ), т.е.
внутренняя сторона мембраны заряжается
положительно относительно наружной.
Затем значение МП быстро возвращается
к исходному уровню. Сильная деполяризация
клеточной мембраны во время ПД приводит
к развитию физиологических проявлений
ри
достижении силы раздражителя определенной
(пороговой) величины происходит быстрое,
активное изменение потенциала покоя -
потенциал действия (ПД), - быстрое
колебание (спайк) мембранного потенциала,
возникающее при возбуждении нервных,
мышечных, некоторых железистых и
растительных клеток; электрический
сигнал, обеспечивающий быструю передачу
информации в организме. Потенциал
действия лежит в основе процесса
возбуждения. Он характеризуется
тем, что значение потенциала покоя
клетки очень быстро уменьшается до 0
(деполяризация), и даже приобретает
положительное значение (+20…+30 мВ), т.е.
внутренняя сторона мембраны заряжается
положительно относительно наружной.
Затем значение МП быстро возвращается
к исходному уровню. Сильная деполяризация
клеточной мембраны во время ПД приводит
к развитию физиологических проявлений
Рис. 4. Изменение мембранного потенциала при действии электрического тока разной силы ЭП - электротонический потенциал, ЛО – локальный ответ, ПД – потенциал действия.
|
возбуждения (сокращение, секреция и др.). Потенциал действия называют распространяющимся возбуждением, поскольку, возникнув в одном участке мембраны, он быстро распространяется во все стороны. Механизм развития ПД практически одинаков для всех возбудимых клеток. |
Ионные основы возникновения потенциала действия. В основе потенциала действия лежит увеличение проницаемости плазматической мембраны, прежде всего для ионов Na+, приводящее к нарушению (изменению) распределения этого иона между вне- и внутриклеточным пространством. Это изменение проницаемости вызывается действием раздражителя, который либо уменьшает заряд мембраны (деполяризует ее), что приводит к открытию воротного механизма электроуправляемых Na+ - каналов у места действия раздражителя, либо действует на воротный механизм хемо-управляемых Na+ - каналов через соответствующий рецептор.
Благодаря наличию химического градиента, через открытые каналы ионы Na+ свободно поступают в клетку и продолжают деполяризовать ее мембрану у места действия раздражителя. Когда величина деполяризации достигнет критической величины (порога), достаточной для открытия воротного механизма соседних каналов, процесс становится необратимым и распространяющимся.
Это состояние автоматического прогрессирующего нарушения мембранного заряда и есть суть возбуждения. Возбуждение пропорционально величине деполяризации, т.е. количеству входящих в клетку ионов, а величина деполяризации характеризуется амплитудой ПД и зависит от силы раздражителя.
Сильная и длительная деполяризация мембраны ведет к инактивации натриевых каналов и прекращению входа Na+. Недостаток положительно заряженных ионов (Na+) снаружи мембраны нарушает электрохимическое равновесие - потенциал покоя, что приводит к повышению калиевой проницаемости. Выход ионов калия наружу через неинактивируемые К+ каналы и потенциалчувствительные, управляемые К-каналы продолжается до восстановления электрохимического градиента т.е. потенциала покоя. Это фаза процесса возбуждения называется фазой реполяризацией.
Окончание процесса возбуждения и переход клетки в состояние физиологического покоя сопровождается активацией натрий - калиевого насоса перекачивающего ионы Nа+ из клетки, а ионы К+ - внутрь ее. В клетке восстанавливается способность к следующему акту возбуждения.
Таким образом, сущность процесса возбуждения заключается в следующем. Все клетки организма имеют электрический заряд, обеспечиваемый неодинаковой концентрацией анионов и катионов внутри и вне клетки. Различная концентрация анионов и катионов внутри и вне клетки является следствием работы ионных насосов и неодинаковой проницаемости клеточной мембраны для разных ионов. При действии раздражителя на клетку возбудимой ткани изменяется проницаемость ее мембраны (сначала повышается для Na+ и быстро возвращается к норме, затем также, но более медленно изменяется для К+), вследствие чего ионы быстро перемещаются в клетку и из клетки согласно электрохимическому градиенту. Эта ответная реакция возбудимой клетки на раздражение, выражающаяся в быстром перемещении ионов в клетку и из клетки согласно электрохимическому градиенту, и есть возбуждение, основой которого является потенциал покоя.
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Основные правила организации физиологического эксперимента.
Физиология - наука экспериментальная, основным методом познания механизмов и закономерностей в ней является эксперимент, позволяющий не только ответить на вопрос, что происходит в организме органе ли клетке, но и выяснить так же, как и почему происходит тот или иной физиологический процесс, как он возникает, за счет каких механизмов поддерживается и управляется. Развитие физиологической науки как науки экспериментальной всегда было связано с успехами физики, электроники, техники. Их бурное развитие в последние десятилетия обеспечило возможность совершенствования физиологических методов исследования.
Успешное выполнение практикума требует, прежде всего, знаний технологии эксперимента и особенно электрофизиологического эксперимента.
Основная, наиболее употребительная аппаратура. Используемые аппараты и приборы можно разделить на две группы: стимулирующая и регистрирующая аппаратура. Стимулирующие приборы используются в качестве раздражителя, имитирующего внешний стимул, регистрирующие - в качестве регистраторов ответных реакций организма или препарата.
Стимулирующая аппаратура. В учебных и научных лабораториях широкое применение в настоящее время получили электростимуляторы. Электростимулятор чаще всего применяется для нанесения ритмического раздражения. Преимущество этого прибора заключается в том, что он позволяет более тонко и точно дозировать и широко варьировать силу, частоту и длительность раздражения, а также наносить одиночный стимул. Существует достаточно большое количество стимуляторов используемых в экспериментальной электрофизиологии. Электростимуляторы используемые в лабораторном практикуме, по возможности, должны отвечать следующим требованиям:
Э
 лектростимулятор
генерирует импульсы прямоугольной
формы (Рис.5).
лектростимулятор
генерирует импульсы прямоугольной
формы (Рис.5).Электростимулятор позволяет максимально варьировать частоту импульсов (1-1000 Гц), изменяя её дискретно.
Электростимулятор позволяет изменять длительность импульсов (от 0,05 до 3 с), изменяя её дискретно.
Электростимулятор позволяет изменять амплитуду импульсов (от 0 до 15 В), изменяя её дискретно. На выходе имеется делитель напряжения 1:1, 1:10, 1:100.
|
|
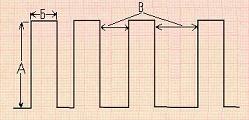
Рис.5. Параметры импульса генерируемого лектростимулятором: А – амплитуда; Б – длительность; В – частота. |
Связующим звеном между источником стимула и объектом исследования служат электроды. Они могут быть стимулирующими (если связаны со стимулятором) и отводящими (если связаны с регистратором).
Регистрирующая аппаратура. В подавляющем большинстве учебных экспериментов запись ответных реакций препарата осуществляется с помощью кимографа – прибора позволяющего записать сокращения сердца, скелетных и гладких мышц, дыхательные движения грудной клетки и др. при этом движения объекта исследования записываются в виде кривой специальными чернильными писчиками на поверхности движущегося барабана, обернутого листом бумаги (Рис. 6).
Барабан приводится в движение часовым механизмом или электромотором при помощи фрикционной передачи. Скорость вращения барабана можно изменять. Писчик миографа присоединяют к бумаге, покрывающей барабан. Писчик вычерчивает кривую, соответствующую ответной реакции исследуемого органа.
Миографы. Запись движений объекта исследования проводят специальными миографическими рычажками, которые закрепляют в штативе и прикрепляют к органу с помощью ниток, или пневматическими устройствами, т. е. через воздушную передачу (капсула Маре). Применяют двуплечий (угловой) и одноплечий (прямой) рычажки.
Прямой рычажок, как правило, применяют для записи сокращений мышцы нервно-мышечного препарата. Он представляет собой подвижно укрепленный на горизонтальной оси рычаг с писчиком на конце, в нем направления движений регистрирующегося и короткого плеч совпадают. Такой миограф фиксируется на штативе вертикально, и мышца соединяется с ним под прямым углом (рис. 6).
Угловой миограф используют для записи сокращений мышц в тех случаях, когда опыт проводят на цельной лягушке, например для регистрации сокращений сердца. Угловой миограф представляет собой горизонтально закрепленный рычаг, одно плечо которого короче другого. Короткая часть этого рычага при помощи нитки соединяется с мышцей. На конце другого (длинного) плеча рычага находится писчик, регистрирующий на кимографе сокращение мышцы
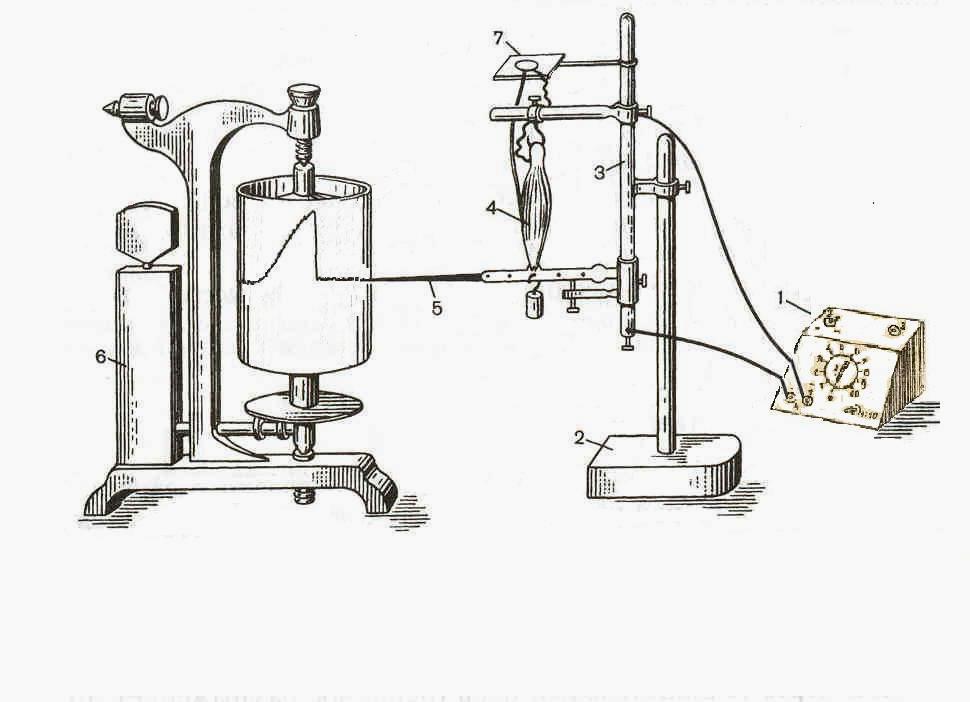
Рис. 6. Схема установки для работы с нервно-мышечным препаратом.
1 – электростимулятор, 2 – штатив, 3 – вертикальный миограф, 4 – нервно-мышечный препарат, 5 – миографический рычажок, 6 – кимограф, 7 – столик для размещения седалищного нерва.
Растворы необходимые для поддержания жизнедеятельности препарата.
Для сохранения жизнедеятельности препарата применяют изотонический раствор хлорида натрия (0,65%-ный раствор для холоднокровных, 0,9%-ный - для теплокровных). Такие растворы называют физиологическими. Для длительного поддержания жизнедеятельности препарата раствор должен содержать не только хлорид натрия в определенной концентрации, но и другие вещества (например, соли калия, кальция и др.). Эти растворы названы именами ученых, предложивших данный раствор (главным образом, на основании опытов на изолированных органах). Ниже приводится состав наиболее употребительных в физиологическом эксперименте растворов для холоднокровных и теплокровных животных.
Таблица. Растворы необходимые для поддержания жизнедеятельности препарата.
Наименование веществ |
Физиологический раствор |
Раствор Рин-гера для холо-днокровных |
Раствор Ринге-ра - Локка для теплокровных |
Жидкость Тироде для теплокровных |
|
Для холод-нокровных |
Для тепло- кровных |
||||
Дистиллированная вода |
100 мл |
100 мл |
100 мл |
100 мл |
100 мл |
Хлорид натрия |
0.65 г |
0.9 г |
0.65 г |
0.9 г |
0.8 г |
Хлорид калия |
|
|
0.014 г |
0.042 г |
0.02 г |
Хлорид кальция |
|
|
0.012 г |
0.024 г |
0.02 г |
Гидрокарбонат натрия |
|
|
0.01 г |
0.02 г |
0.02 г |
Хлорид магния |
|
|
|
|
0.01 г |
Фосфат натрия |
|
|
|
|
0.005 г |
Глюкоза |
|
|
|
0.1 г |
0.1 г |
Инструменты для препарирования.
Для выполнения работ, приведенных в практикуме, можно обойтись следующим набором инструментов. Ножницы большие с прямыми концами, один из которых острый,. нотницы маленькие (глазные) для тонкой препаровки, необходимые при выполнении большинства работ по физиологии нервной системы и физиологии кровообращения. Пинцеты: анатомический, глазной. Препаровальная игла. Булавки (главным образом, для прикрепления лягушки к пробковой пластине).Скальпель необходим только для некоторых работ, например для вскрытия глаза, для операции к опыту Сеченовского торможения. Нитки. Гальванический пинцет. Различные зажимы и канюли .
Способы обездвиживания лягушки
Лягушка — традиционный объект биологических, в том числе физиологических, исследований, что связано с её доступностью, легкостью в содержании и холоднокровностью. Последнее особенно важно, так как позволяет не учитывать изменение температуры, при приготовлении из лягушки различных физиологических препаратов.
Международные правила защиты животных предусматривают эксперименты на них с учебной и исследовательской целью, категорически запрещая при этом всякую вивисекцию, т. е. операции на живых, не наркотизированных или на не обездвиженных и не обезболенных объектах. Все опыты на них проводят после наркотизации и последующего разрушения спинного мозга, в котором проходят проводящие болевые пути.
Применение наркоза (эфира, спирта, уретана). Для наркотизации лягушки применяется 10%-ный раствор спирта или 2%-ный раствор эфира. Лягушку опускают в раствор на 10-15 мин. Расслабление мускулатуры и отсутствие двигательной активности - хорошие показатели достаточного действия наркоза. Уретан вводится под кожу. Для наркотизации лягушки достаточно 1 мл 5%-ного раствора уретана, его действие наступает через 15-20 мин.
Для многих работ практикума по физиологии необходимо обездвижить лягушку. Сделать это можно одним из следующих способов. Разрушьте головной и спинной мозг лягушки двумя описанными ниже способами: сначала первым, а затем вторым (неважно, что мозг уже разрушен - важно научиться делать пере резки на нужном уровне и научиться вставлять иглу в спинномозговой канал).
Разрушение головного и спинного мозга. Возьмите лягушку в левую руку спиной вверх, так чтобы большой палец лежал на ее спине. Указательный палец положите на верхнюю челюсть лягушки и наклоните ее голову вниз. В таком положении хорошо видно место расположения затылочной ямки. Через ямку между затылочной костью и позвоночником введите препаровальную иглу на глубину 1—2 мм поверните ее вверх параллельно спинномозговому каналу и продвиньте до крестцово-копчикового соединения, круговыми движениями разрушая спинной мозг. Извлеките иглу из центрального канала и, повернув ее на 180 °, введите ее в полость черепа и разрушьте головной мозг.
Критерием разрушения является полная релаксация (расслабление) всех групп мышц лягушки и отсутствие защитных двигательных рефлексов на пощипывание кожи и потягивание за лапку. При этом способе обездвиживания лягушки теряется очень мало крови
Декапитация с последующим разрушением спинного мозга. Возьмите лягушку в левую руку, а правой введите как можно глубже нижнее лезвие ножниц в рот под заднюю часть верхней челюсти. Быстрым движением отрежьте верхнюю челюсть на уровне заднего конца барабанных перепонок (нижнюю челюсть сохраните). В отверстие спинномозгового канала введите препаровальную иглу и разрушьте спинной мозг.
Следует помнить, что физиологические работы связаны с использованием: электрических приборов с опасным для жизни напряжением, растворов кислот и щелочей способных вызвать травму при попадании на кожу, слизистые или внутрь, легковоспламеняющихся жидкостей, возгорание которых может привести к пожару. Все это требует неукоснительного соблюдения принятых в лаборатории правил техники безопасности.
ПРАКТИЧЕСКИЕ ЗАДАНИЯ
Классическим объектом исследования в физиологии возбуждения является нервно-мышечный препарат, на котором великие физиологи — Л. Гальвани, К. Маттеучи, И.М. Сеченов, Н.И. Введенский и др. открыли основные закономерности функционирования живого организма. Поэтому первое занятие по этой теме посвящается методике и технике его приготовления и истории изучения электрических процессов в живых тканях.
