
- •В. И. Летунов Аналитическая химия и физико-химические методы анализа
- •Рецензент: д-р. Ф.-м.Н., доцент н. П. Степанов. Задания для контрольной работы обсуждены на заседании кафедры естественнонаучных дисциплин зип СибУпк. Протокол № 7 от 22.03.2012 г.
- •Содержание
- •Введение
- •Программа курса
- •Правила оформления контрольной работы
- •Методические рекомендации
- •Варианты контрольной работы
- •Решение типовых задач
- •К массе раствора. Пример 1
- •Пример 2
- •Пример 3
- •Пример 4
- •2. Находим массу кислоты в образце.
- •Пример 5
- •Молярная масса эквивалента окислителя (восстановителя) рассматривается как отношение молярной массы вещества к числу электронов, принявших участие в реакции.
- •Пример 6
- •Пример 7
- •Пример 8
- •Задачи контрольной работы
- •БиблиограФический список
- •Аналитическая химия и физико-химические методы анализа
- •672086, Г. Чита, ул. Ленинградская, 16.
Пример 4
Рассчитать массовую долю Н2С2О4 • 2Н2О в анализируемом образце, если на титрование раствора, содержащего 0,1650 г образца, израсходовано 25,00 мл 0,1н раствора NaOH.
Решение:
1. Определить TNaOH/H2С2О4 • 2Н2О (ТNaОН/к-те).
ТNaОН/к-те
=
 =
0.006303
г/мл.
=
0.006303
г/мл.
2. Находим массу кислоты в образце.
MH2C2O4 = TNaOH/к-те • VNaOH = 0,006303 • 25,00 = 0,1576 г.
3. Находим массовую долю кислоты в образце.
ω Н2С2О4 • 2Н2О = 0,1576/0,1650 = 0,96
Пример 5
К раствору К2Сr2О7 добавили избыток раствора KI. Выделившийся йод оттитровали 35,20 мл 0,05н раствора тиосульфата натрия. Рассчитать массу бихромата калия в исследуемом растворе.
Решение:
1. Составим уравнение реакции:
K2Cr2O7 + 6KI + 7Н2О = 4K2SO4 + Cr2(SO4)3 + 3I2 +7H2O.
В этой реакции изменяется степень окисления хрома и йода.
Сr2О7-2
+ 2 • З![]() +14н+
= 2Сг3+
+ 7Н2О.
+14н+
= 2Сг3+
+ 7Н2О.
2I- - 2 = 102
При титровании происходит реакция:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI;
2S2O2-3 - 2 = S4O2-6
I2+2 =2 I-
Молярная масса эквивалента окислителя (восстановителя) рассматривается как отношение молярной массы вещества к числу электронов, принявших участие в реакции.
Мэк
К2Сr2О7
=
 = 49,06 г/моль
= 49,06 г/моль
Mэк
Na2S2O3
=
 248
г/моль
248
г/моль
2. Определяем титр тиосульфата по бихромату.
Т
Na2S2O3/K2Cr2O7
=
 =0.002492
г/мл
=0.002492
г/мл
3. Находим количество бихромата калия в анализируемом растворе:
m K2Cr2O7 = T Na2S2O3/ K2Cr2O7 • V Na2S2O3 = 0,002482 • 35,20 = 0,0873 г.
Пример 6
Определить массовую долю золя канифоли (ω), если известно, что интенсивность рассеянного света стандартного золя (Wcт. = 0,025) и исследуемого раствора оказались равны при высоте освещенной части золей hст. = 3 • 10-1см, hиск. = 14 • 10-1см.
Решение:
Из
уравнения Релея Iρ
= I° ,
(Iρ
– интенсивность рассеянного света, V
– объем частицы) следует, что если объемы
дисперсных частиц равны, то
,
(Iρ
– интенсивность рассеянного света, V
– объем частицы) следует, что если объемы
дисперсных частиц равны, то
 ,
следовательно,
,
следовательно,
 ,
вместо соотношения интенсивностей
рассеянного света можно ввести соотношение
,
вместо соотношения интенсивностей
рассеянного света можно ввести соотношение
 ,
следовательно,
,
следовательно,
 .
.
Пример 7
Определить массовую долю яблочной кислоты в растворе, угол вращения плоскости, поляризации которого равен αисп. = 0,8°. Угол вращения плоскости поляризации стандартного раствора (ωст. = 0,02) равен +0,46°. Длина поляриметрической трубки 1 дм.
Решение.
1.
![]() ,
отсюда находим удельное вращение:
,
отсюда находим удельное вращение:
αо
=
![]() ;
;
![]() .
.
2. Находим массовую долю яблочной кислоты в растворе:
 =
0,03
=
0,03
Пример 8
При решении задач по физико-химическим методам анализа пользуются методом градуировочного калибровочного графика.
Методом полярографии стандартных растворов, содержащих медь, получены следующие результаты:
Номер образца |
1 |
2 |
3 |
4 |
5 |
Содерж. меди (ω) |
0,10 |
0,19 |
0,32 |
0,41 |
0,54 |
Высота полярограф. Волны (h) мм |
6 |
12 |
20 |
26 |
36 |
Определите содержание меди в исследуемом образце, если высота полярографической волны для него равна 15 мм.
Решение.
Необходимо построить градуировочный график (который строится на миллиметровой бумаге) по результатам анализа стандартных растворов.
h мм
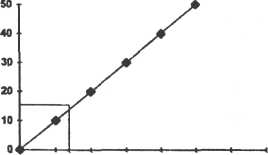 ω
ω
По градуировочному графику находим концентрацию исследуемого раствора. ω =0,145.
