- •5.Будова і основні особливості вимірювальних приладів магнітоелектричної системи.
- •6. Будова і основні особливості вимірювальних приладів електромагнітної системи.
- •7.Означення класу точності на шкалі приладів.
- •9.Класифікація твердих тіл: діелектрики,н/п,метали.
- •10. Сингонії і кристалографічні класи.
- •12.Гратки Браве.
- •13.П'єзоефекти в кристаллах.
- •14.Анізотропія і симетрія зовнішньої форми, фізичних властивостей та структури кристалів.
- •16.Диференціальне рівняння теплопровідності. Знаходження роз’язку рівняння класичним методом.
- •18.Каскадне охолодження.
- •§ 2. Нерівноважна кристалізація сплавів, що утворюють твердий розчин
- •24.Подвійні системи з простою евтетикою.
- •25. Методи вирівнювання концентрації домішок в монокристалах вирощених розплавів.
- •26. Контрольоване введення радіаційних порушень з допомогою іонної імплантації.
- •27. Лазерна технологія.Лазерний відпал,легування,руйнування.
- •28.Тигельні методи вирощування кристалів. Направлена кристалізація в тиглі або в човнику.
- •29. Теорема Блоха.
- •30.Зони Бріллюена.
- •31.Оператор Квазіімпульса.
- •32.Ефективна маса носіїв струму.
- •33.Рівняння Больцмана.
- •34.Наближення часу релаксації.
- •35.Рівняння Шредінгера для кристала. Адіабатичне наближення розв’язку рівняння Шредінгера.
§ 2. Нерівноважна кристалізація сплавів, що утворюють твердий розчин
Розглянемо нерівноважну кристалізацію сплаву складу 50% Сu — 50% Ni, що протікає в реальних умовах. Перші кристали твердої фази утворюються при температурі Т1 (фіг. 22) і мають склад С1. Оскільки утворена тверда фаза збагачена нікелем у порівнянні з рідиною, рідина, що оточує її, буде збіднена нікелем. Проте в цьому випадку вирівнювання концентрації в рідині не устигає статися, і шар рідини, що безпосередньо примикає до твердої фази, залишається з дещо пониженим вмістом нікелю і підвищеним вмістом міді. Кристалізація відбувається на межі розділу твердою і рідкою фаз, і тому наступний шар твердої фази, що утворюється, буде збагачений міддю в порівнянні з шаром, що утворюється в рівноважних умовах, оскільки він за-кристаллизовался з рідини, багатішою міддю.
В результаті нерівноважної кристалізації утворюєтьсяся структура, що складається з шарів з різним складом. Це може бути ясніше видно з аналізу діаграми стану, приведеної на фіг. 22. У міру протікання процесу кристалізації склад твердої фази змінюється від С1 до С3 при температурі T2 Досягнувши температури T3 склад твердої фази змінюється від C1 до С0; при цьому тверда фаза, що утворилася на початку процесу, має концентрацію С1 а тверда фаза, що утворилася при T3, має концен-трацию С0. Оскільки кінцева середня концентрація усій
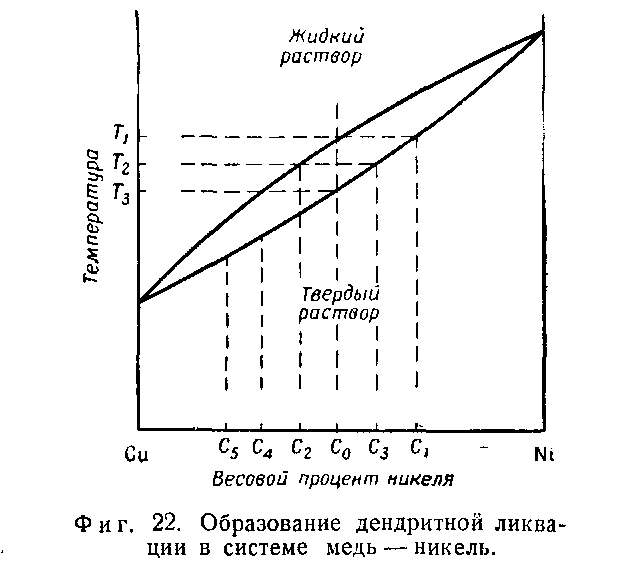
твердої фази має бути рівна початковою концентрації С0, то досягши температури Т3 залишається рідина, що має концентрацію С4, С5 і т. д.; ця рідина перетворюється на тверду фазу тієї ж концен-трации і середній склад твердої фази стає рав-ным С0.
У вибраному сплаві відмінність у складі твердої фази, що утворилася на початку і кінці процесу кри-сталлизации, може бути дуже великою, що призводить до розвитку внутрішньокристалічної ліквації і утворенню характерної дендритної структури.
22. Тверді розчини з перететикою. Хід кристалізації.
Якщо температура плавлення твердих розчинів зменшується з боку компоненти А (В), а з боку компонента В (чи А) підвищується при їх обмеженій розчинності один в одному, то можливе перитектичне перетворення, яке є процесом утворення фази за рахунок взаємодії двох інших, повністю або частково исче-зающих при цьому (рідина реагує з раніше випавшими кристалами і утворює новий вид кристалів) :
L + а ->β. Реакція подібного типу називається перитектичною.
Розглянемо діаграму стану з перитектичним перетворенням (мал. 4.10).
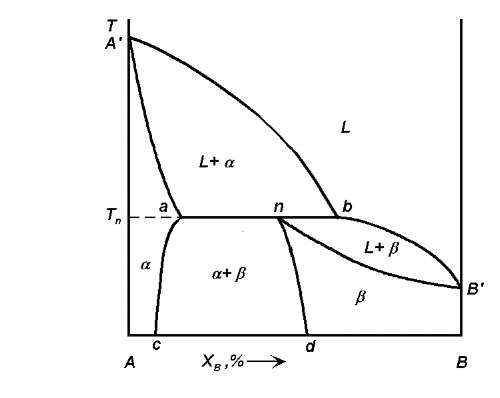
Рис. 4.10. Діаграма стану бінарної системи, що утворює тверді розчини
Лінія А' bВ' – лінія ліквідуса; лінії А'а і пВ' — лінії солідусу; лінії ас і nd – лінії твердих розчинів граничної концентрації, існуючих при температурах нижче перитектичної температури TП. При температурі ТП в рівновазі знаходяться три фази: рідка і дві тверді фази – L + а + β. Горизонтальна лінія ab називається перитектичною горизонталлю і її точки не відповідають реально існуючим фазам (як і на евтектичнійгоризонталі), окрім трьох точок a, n і b.
При охолодженні сплавів складів від 0 до а кристалізація проходить аналогічно кристалізації сплавів складів від 0 до з на діаграмі стану з евтектичним перетворенням.
При охолодженні сплавів, склади яких лежать в інтервалі від α до n, кількість рідкої фази при температурі TП недостатньо для то-го, щоб сталася взаємодія з усією твердою фазою α. У результаті після перитектичного перетворення, окрім нової фази β, сплави міститимуть і надмірна кількість кристалів фази α. При ТП склад рідкої фази відповідатиме точці b (точка перитектичного превраще-ния рідини), а склад кристалів — точці а (точка перитектическо-го перетворення твердого розчину α). Ці обидві фази реагують і дають третю фазу β, склад якої визначається точкою n (точка перитектического перетворення твердого розчину β). Кількісне співвідношення фаз, що беруть участь в перитектичній реакції, визначається правилом важеля. При подальшому охолодженні сплави є меха-ническую сумішшю твердих розчинів α + β, склади яких змінюються по кривих ас і nd відповідно, а кількісне співвідношення фаз визначається правилом важеля.
Аналогічно для сплавів, склади яких лежать в інтервалі від п до Ь, кількість фази α при β мало в порівнянні з кількістю рідкої фази. В результаті перитектичного перетворення ми отримаємо двух-фазную систему L + β. При подальшому пониженні температури склад рідкої фази змінюється по лінії bВ', а склад тих, що утворюються кристаллов — по пВ'. Кількісне співвідношення фаз визначається правилом важеля.

Рис.4.11. Діаграма стану системи InSe - GaSe.
Важливою особливістю системи з перитектикою є те, що при температурі ТП кристалізація ряду складів сплаву завершується не повністю. Для сплавів складу від n до b кристалізація завершується на лінії пВ' при температурах нижче TП і при цьому утворюється твердий розчин β.
Подібного типу діаграми стану рідко зустрічаються в полупро-водниковых системах, проте, прикладом може служити система InSe - GaSe (мал. 4.11). По перитектичній реакції в цій системі обра-зуется β фаза (InGa2Se3).
23. Конгурентне та інконгруентне плавлення сполук з утворенням твердих розчинів.
Діаграми стану з проміжними фазами
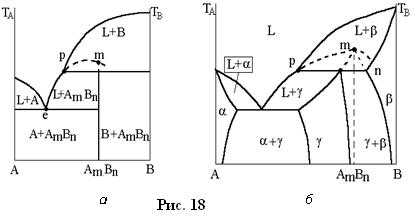
Усі тверді фази, які утворюються в системі між граничними твердими розчинами, назвемо проміжними фазами. Проміжні фази можуть мати постійний і змінний склад.Проміжні фази постійного складу (хімічні сполуки, фази Лавеса, деякі електронні з'єднання) на діаграмі зображаються вертикальними лініями (області гомогенності практично відсутні). Проміжні фази змінного складу (фази впровадження, деякі електронні з'єднання, s -фазы та ін.) мають порівняно широкі області гомогенності. Ці фази можна розглядати як тверді розчини на базі певних хімічних сполук. Проміжні фази, при плавленні яких склади твердої і рідкої фаз співпадають, називаються конгруентно плавкими. Типові діаграми приведені на рис.17 (а, б).
|
Якщо проміжна фаза є фазою постійного складу, то вертикаль хімічної сполуки АmВn ділить усю діаграму на дві частини, які можна розглядати як самостійні діаграми (рис.17, а). Сплави, склади яких лежать лівіше за хімічну сполуку, можна отримувати, сплавляючи компонент А з хімічною сполукою, аналогічно сплави правіші за хімічну сполуку – сплавляючи компонент В і хімічну сполуку АmВn. Такі діаграми характерні для систем, утворених металами і елементами, що мають і металеві, і неметалічні властивості, а проміжна фаза зазвичай є хімічною сполукою з нормальною валентністю або напівпровідниковою фазою. Якщо конгруентно плавка проміжна фаза є фазою змінного складу, то на діаграмі з'являються області гомогенності (область g фази на рис.17, б). Сплави, розташовані в області лівіше АmВn, можна розглядати як твердий розчин компонента А в хімічній сполуці, а сплави, розташовані правіше, як розчин компонента В в цьому ж з'єднанні. Область гомогенності може розташовуватися і по одну сторону від хімічної сполуки. У усіх випадках хімічна сполука плавитиметься при постійній температурі, яка зазвичай вище за температури плавлення чистих компонентів. Точка максимуму m називається дистектичною точкою (дистектичний з греч. - важко плавкий, тугоплавкий), а самі конгруентно плавкі фази - фазами з відкритим максимумом. У роботах Н.С. Курнакова показане, що гострота відкритого максимуму залежить від стійкості хімічної сполуки, тобто від міри дисоціації за схемою АmВn <=> mА + nВ. Якщо з'єднання при плавленні практично не диссоціює, то криві ліквідуса і солидуса g -фази перетинаються в точці m, утворюючи гострий максимум. |
Якщо хімічна сполука стійка в твердому стані, але помітно диссоціює в рідкому (при плавленні), то криві солідусу залишаються з гострою вершиною, а крива ліквідус в точці максимуму буде плавним (як на рис.17, б).
Якщо хімічна сполука диссоціює і в рідкому, і в твердому стані, то максимум на кривих ліквідуса і солідусу буде згладженим. За відсутності дисоціації або при дисоціації тільки в рідкому стані точка m відповідає стехіометричному складу соединенияАmВn, зазвичай таке з'єднання підкоряється закону Дальтона, тому такі фази названыдальтонидами. Характерною ознакою дальтонидов є наявність сингулярныхточек, тобто точок максимуму або мінімуму на залежностях фізичних властивостей від складу (точка S на залежності, рис.15, б).
У разі сильної дисоціації хімічної сполуки дистектична точка не співпадає із складом з'єднання. Проміжні фази, утворені на базі таких з'єднань, називаються бертолідами, вони характеризуються широкими областями гомогенності і плавними залежностями властивість - склад в межах області гомогенності, сингулярні точки відсутні.
Проміжні фази, при плавленні яких склад рідкої фази, що утворюється, відрізняється від складу твердої фази, називаються інконгруентними плавкими (інконгруентний - неспівпадаючий). Строго кажучи, тут треба говорити не про плавлення, а про розпад фази по реакції, зворотній перитектичній. Так, хімічна сполука АmВn (рис.18, а) стійко лише до температури перитектичної реакції, а потім розпадається по реакції
АmВn ---> Lp + В.
|
Аналогічно для g - фази (рис.18, б) можна записати: gm---> Lp + bn. Таким чином, при розпаді виділяється рідка фаза і утворюється нова тверда фаза. Утворення цих фаз відбувається по перитектичній реакції. Інконгруентні плавкі фази називають також фазами з прихованим максимумом (штрихові лінії на рис.18, а, б), підкреслюючи цим, що у фаз відсутня дистектична точка на кривих ліквідуса і солідусу. Прихований максимум відповідає складу хімічної сполуки АmВn (рис.18, а), якщо ж фаза змінного складу, то прихований максимумm, може виявитися за межами області гомогенності ( рис.18, б). |