
- •Билет №1
- •Билет №2
- •Вероятностный подход
- •Физический подход
- •Порядок решения задач при использовании физического подхода
- •Билет №3
- •Газовая коррозия
- •Коррозия при полном и неполном погружении металла в жидкую коррозионную среду
- •Билет №4
- •Испытание на непроницаемость
- •Испытания на герметичность
- •Билет №5
- •Билет №6
- •Билет №7
- •Билет №8
- •Билет №9
- •Билет №10
- •Билет №11
- •Билет №12
- •Билет №13
- •Билет №14
- •Билет №15
- •Билет №16
- •Билет №17
- •Билет №18
- •Билет №19
- •Билет №20
Билет №3
1.Классификация коррозионных разрушений. Кинетика электрохимических процессов.
2.Проблема остаточных напряжений при секционно-блочном способе ремонта корпуса.
1.
Коррозия металлов - разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой (с жидкостями, газами).
Первопричиной коррозии является термодинамическая неустойчивость металла в различных средах при разных внешних условиях. Количественная характеристика коррозии – ее скорость. Т.е. коррозионные потери единицы поверхности металла в единицу времени.
 [мм/год]
[мм/год]
 -глубинный
показатель коррозии, П - глубина
разрушения,
-глубинный
показатель коррозии, П - глубина
разрушения,

Коррозионные процессы классифицируют:
1) по механизму реакций, взаимодействия металла с коррозионной средой
2) по геометрическому характеру коррозионных разрушений на поверхности или в объеме металла.
3)по условиям протекания коррозии
К первому типу относят химическую и электрохимическую.
Химической коррозией называется взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окислительной компоненты коррозионной среды протекают в одном акте. Химическая коррозия опасна для элементов, работящих в условиях высоких температур.
Химический механизм этой коррозии проявляется в виде проходящей на одном и том же участке поверхности в одну стадию и независящей от потенциала металла без участия свободных электронов, когда металл, отдавая окислителю валентные электроны, вступает с ним в химическое единение или образует ионы.
Электрохимической коррозией металлов называется взаимодействие металла с коррозионной средой, при котором ионизация атомов металла и восстановление окислительной компоненты коррозионной среды протекает не в одном акте, а их скорости зависят от электродного потенциала. Схема электрохимической коррозии состоит из анода и катода, погруженных в раствор электролита.
Условия протекания электрохимической коррозии:
Большее значение электродного потенциала катода по сравнению с анодом.
Поляризация – уменьшение скорости коррозии, которое достигается путем уменьшения силы тока между катодом и анодом, которое происходит при сближении потенциалов катода и анода.
Явление, противодействующее поляризации электрода называют деполяризацией. Деполяризация (анодная и катодная) ускоряет процесс коррозии. Поляризацию можно уменьшить или вообще предотвратить добавлением соответствующих веществ, называемых деполяризаторами.
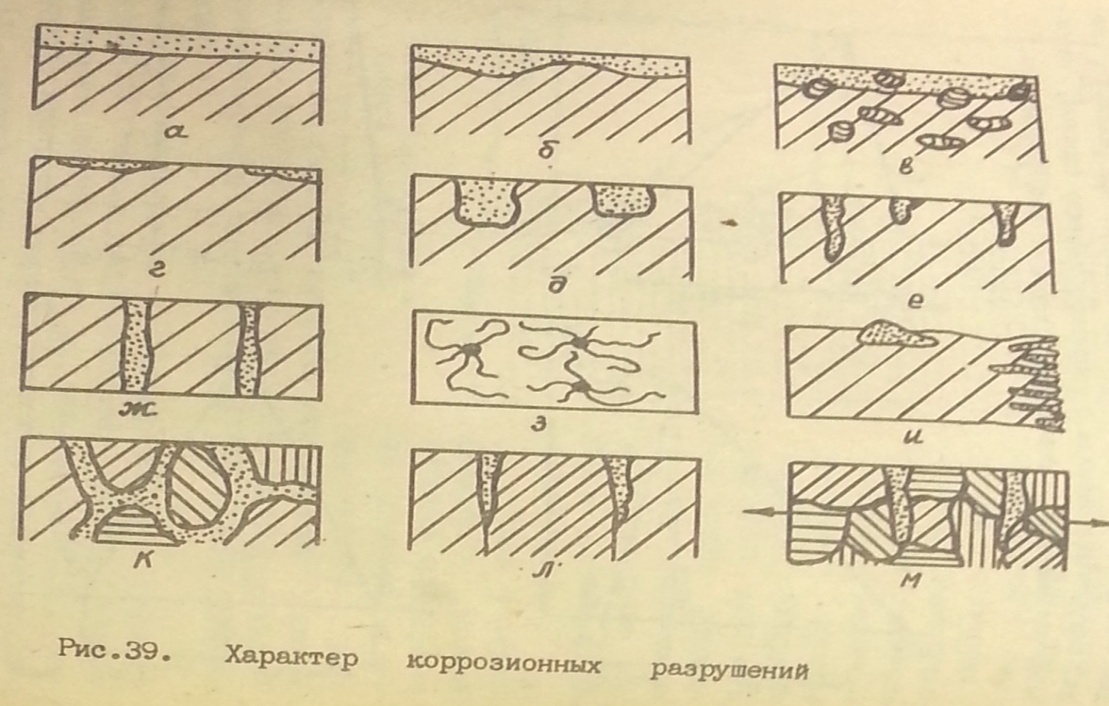
Ко второму типу относят сплошную (общую) и местную.
Виды сплошной коррозии:
-равномерная (а)
-неравномерная (б)
-избирательная (в)
Виды местной коррозии:
-пятнами (г)
-язвами (д)
-точечная - питтинг-коррозия (е)
-сквозная (ж)
-подповерхностная (и)
-межкристаллитная (к)
-нитевидная (з)
-ножевая (л)
-коррозионное растрескивание (одновременное воздействие коррозионной среды и растягивающих напряжений) (м)
К третьему типу относят газовую, при различных видах погружения металла в коррозионную среду, атмосферную (в атмосфере воздуха).
