- •5. Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
- •6. Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия.
- •8. Классификация дисперсных систем: по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой.
- •10. Осмос, осмотическое давление. Закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
- •11. Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
- •12. Факторы устойчивости коллоидных растворов. Механизм возникновения электрического заряда коллоидной частицы. Мицелла. Ядро. Гранула.
- •13. Ионное произведение воды. Методы определения pH растворов. Индикаторы.
- •Методы определения значения pH
- •14. Протолитические реакции. Понятия о кислотах и основаниях. Амфолиты. Ионизация слабых кислот и оснований. Константа кислотности и основности.
- •15. Буферные системы: определение, классификация, уравнение Гендерсона-Гассельбаха. Механизм действия буферных систем. Зона буферного действия и буферная емкость
- •16. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Взаимодействие буферных систем организма человека.
- •17. Понятие о кислотно-основном состоянии организма. Виды нарушений кос и способы коррекции.
- •18. Типы окислительно-восстановительных реакций, протекающих в организме.
- •19. Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий.
- •20. Классификация комплексных соединений, их строение. Представление о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины).
- •21. Типы изомерии органических соединений.
- •1.Структурная изомерия.
- •2.Пространственная изомерия.
- •22. Многоатомные спирты: этиленгликоль, глицерин, инозит. Их структура и функции. Образование сложных эфиров с неорганическими кислотами (нитроглицерин, фосфаты глицерина, инозита).
- •24. Аминофенолы: дофамин, норадреналин, адреналин. Понятие о биологической роли этих соединений и их производных.
- •26. Насыщенные дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая. Соли щавелевой кислоты- оксалаты.
- •27. Ненасыщенные дикарбоновые кислоты: фумаровая, малеиновая, их пространственное строение. Превращение янтарной кислоты в фумаровую как пример биологической реакции дегидрирования.
- •30. Классификация углеводов (моно-, олиго-, полисахариды). Моносахариды, их классификация (альдозы, кетозы).
- •31. Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.
- •34. Дисахариды: классификация (редуцирующие- мальтоза, целлобиоза, лактоза) и нередуцирующие (сахароза, трегалоза). Строение, химические свойства: гидролиз, окисление редуцирующих сахаров.
- •35. Классификация полисахаридов (гомо- и гетерополисахариды). Примеры.
- •36. Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза. Структура, типы, химических связей, гидролиз.
- •37. Липиды: определение, классификация.
- •39. Простые (нейтральные липиды) – триглицериды. Номеклатура, состав, строение, их гидролиз.
- •40. Фосфатидная кислота. Её образование и гидролиз.
- •41.Фосфолипиды: фосфатидилсерины, фосфатидилэтаноламины и фосфатидилхолин (лецитины) – реакция гидролиза.
- •42.Стероиды: структура холестерина, желчных кислот.
- •43.Липидный состав мембран. Амфифильная природа мембранных липидов.
- •44.Классификация нуклеиновых кислот.
- •45.Пиримидиновые и пуриновые основания. Ароматические свойства. Лактим-тактамная таутометрия.
- •46.Нуклеозиды: номенклатура, строение, гидролиз.
- •47. Нуклеотиды: номенклатура, строение, гидролиз
- •48.Первичная структура нуклеиновых кислот: химический состав рнк и днк, типы химических связей.
- •49.Вторичная структура днк. Роль водородных связей в формировании вторичной структуры. Комплиментарные пары. Третичная структура днк.
- •50.Природные аминокислоты.Номенклатура и стереоизомерия.
- •51.Классификация аминокислот по: строению радикала, кислотно-основным свойствам.
- •52.Кислотно-основные свойства аминокислот, биполярная структура, изоэлектрическая точка.
- •53.Химические свойства α-аминокислот как гетерофункциональных соединений: реакции этерификации, ацилирования, алкилирования, образование иминов, реакция комплексообразования.
- •5,4. Биологические важные реакции α-аминокислот
- •55. Первичная структура белка. Строение пептидной группы. Гидролиз пептидов.
- •56. Вторичная, третичная, четвертичная структуры белка. Химические связи, участвующие в образовании структур белка. Биологическая роль структурной организации белковых молекул.
- •59. Миоглобин и гемоглобин: строение и функции.
- •60. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина (кооперативный эффект). Эффект Бора. Роль 2,3 – бисфосфоглицерата.
- •61. Особенности ферментов как белковых катализаторов. Активный центр, кофакторы и коферменты. Механизм действия ферментов. Этапы ферментативного катализа.
- •62. Классификация и номенклатура ферментов.
- •64. Зависимость активности ферментов от температуры и pH среды. Единицы активности ферментов.
- •65. Специфичность действия ферментов.
- •66. Аллостерические ферменты: структура, аллостерический и регуляторный центры. Гомо- и гетеротропные эффекты.
- •67. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное.
- •I. Обратимое ингибирование
- •68. Индукция и репрессия синтеза ферментов. Компартментация ферментов. (Нихуя не нашел толком. Говно, а не ответ)
- •69. Виды регуляции ферементов: ассоциация-диссоциация.
- •70. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
- •71. Применение ферментов и их ингибиторов в медицине (диагностика, лечение). Энзимопатии.
59. Миоглобин и гемоглобин: строение и функции.
Миоглоби́н — кислородосвязывающий белок скелетных мышц и мышцы сердца, связывающий переносимый гемоглобином О2 и передающий его окислит. системам клетки.
Гемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях.
Два белка – гемоглобин и миоглобин – часто называют дыхательными ферментами Оба этих вещества выполняют роль переносчиков при дыхании: гемоглобин – основной компонент красных кровяных телец2 (эритроцитов), переносящих по артериям кислород из легких к тканям; миоглобин – красный белок в мышцах, принимающий кислород от гемоглобина и хранящий его там до того момента, когда он потребуется для окисления пищевых веществ. Эти процессы в организме сопряжены с одновременным переносом углекислого газа, переправляемого из тканей в легкие, в основном в виде бикарбоната. Перенос бикарбоната и углекислого газа идет также при содействии гемоглобина.
Миоглобин и гемоглобин представляют собой белки, соединенные с железосодержащим пигментом – гемом3 (рис. 2). Белковая часть миоглобина содержит около 2500 атомов углерода, азота, кислорода, водорода и серы, соединенных друг с другом в длинную цепь, образующую своего рода корзинку вокруг группы гема. Все 2500 атомов молекулы миоглобина подчинены единственному атому железа, расположенному в центре гема, они обеспечивают обратимое взаимодействие железа с молекулами кислорода.
Миоглобин скелетных мышц и миоглобин миокарда (сердечной мышцы) слегка различны по аминокислотной последовательности. В практической медицине этот факт используется для определения диагноза инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина (равно как и «сердечных» изотипов некоторых мышечных ферментов) в крови.
В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает.
Подобно гемоглобину, миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию отдавания кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии.
Самоотравление организма свободным миоглобином и как следствие острая почечная недостаточность и тканевая гипоксия — одна из главных причин смерти при синдроме длительного сдавливания (крэш-синдром), встречающемся при тяжелых травмах со сдавлением или размозжением значительных количеств мышечной ткани.
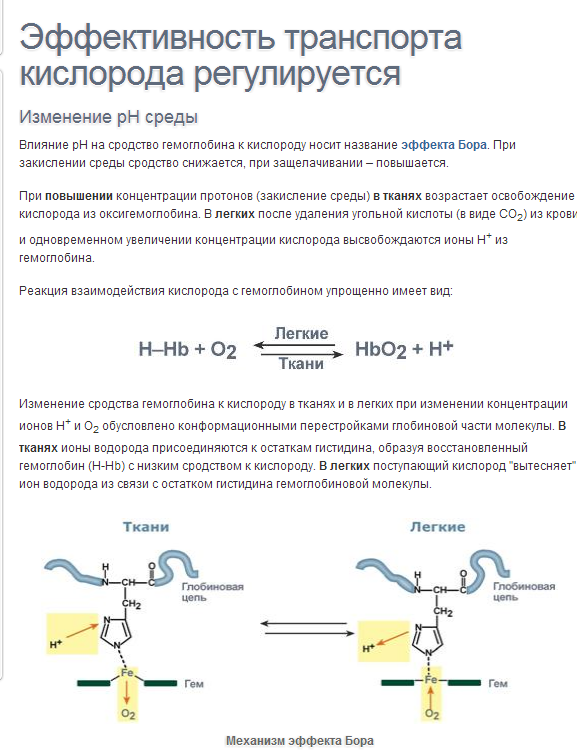
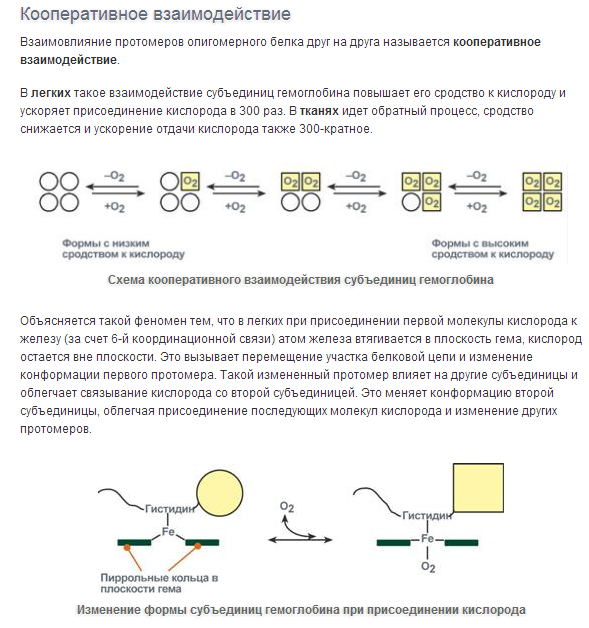
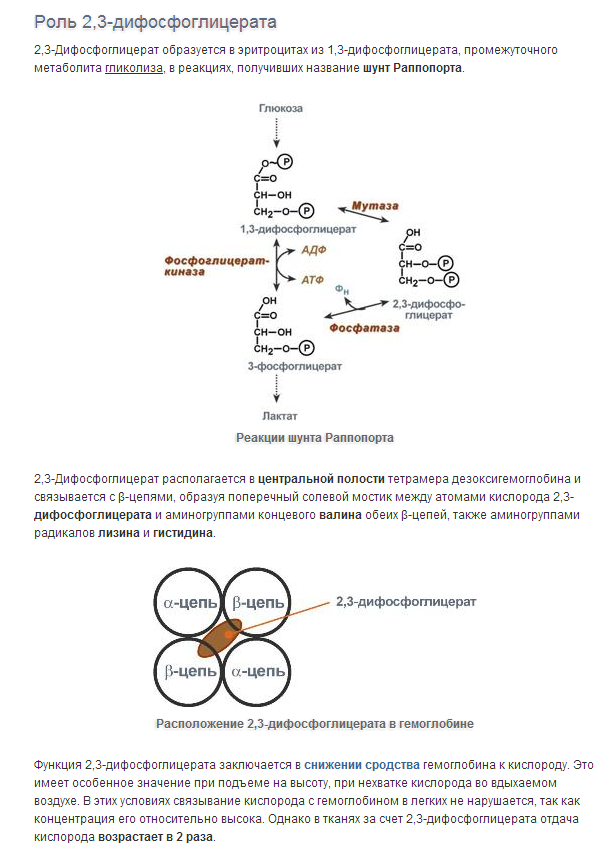
60. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина (кооперативный эффект). Эффект Бора. Роль 2,3 – бисфосфоглицерата.