- •5. Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
- •6. Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия.
- •8. Классификация дисперсных систем: по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой.
- •10. Осмос, осмотическое давление. Закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
- •11. Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
- •12. Факторы устойчивости коллоидных растворов. Механизм возникновения электрического заряда коллоидной частицы. Мицелла. Ядро. Гранула.
- •13. Ионное произведение воды. Методы определения pH растворов. Индикаторы.
- •Методы определения значения pH
- •14. Протолитические реакции. Понятия о кислотах и основаниях. Амфолиты. Ионизация слабых кислот и оснований. Константа кислотности и основности.
- •15. Буферные системы: определение, классификация, уравнение Гендерсона-Гассельбаха. Механизм действия буферных систем. Зона буферного действия и буферная емкость
- •16. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Взаимодействие буферных систем организма человека.
- •17. Понятие о кислотно-основном состоянии организма. Виды нарушений кос и способы коррекции.
- •18. Типы окислительно-восстановительных реакций, протекающих в организме.
- •19. Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий.
- •20. Классификация комплексных соединений, их строение. Представление о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины).
- •21. Типы изомерии органических соединений.
- •1.Структурная изомерия.
- •2.Пространственная изомерия.
- •22. Многоатомные спирты: этиленгликоль, глицерин, инозит. Их структура и функции. Образование сложных эфиров с неорганическими кислотами (нитроглицерин, фосфаты глицерина, инозита).
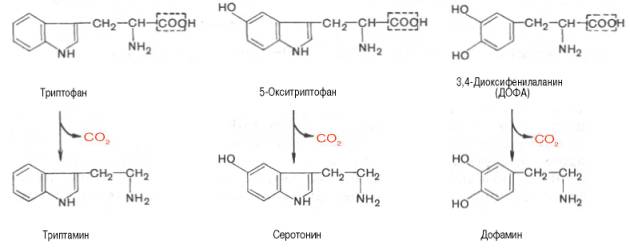
- •24. Аминофенолы: дофамин, норадреналин, адреналин. Понятие о биологической роли этих соединений и их производных.
- •26. Насыщенные дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая. Соли щавелевой кислоты- оксалаты.
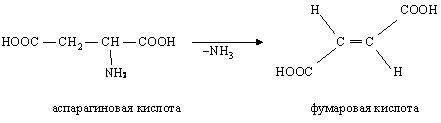
- •27. Ненасыщенные дикарбоновые кислоты: фумаровая, малеиновая, их пространственное строение. Превращение янтарной кислоты в фумаровую как пример биологической реакции дегидрирования.
- •30. Классификация углеводов (моно-, олиго-, полисахариды). Моносахариды, их классификация (альдозы, кетозы).
- •31. Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.
- •34. Дисахариды: классификация (редуцирующие- мальтоза, целлобиоза, лактоза) и нередуцирующие (сахароза, трегалоза). Строение, химические свойства: гидролиз, окисление редуцирующих сахаров.
- •35. Классификация полисахаридов (гомо- и гетерополисахариды). Примеры.
- •36. Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза. Структура, типы, химических связей, гидролиз.
- •37. Липиды: определение, классификация.
- •39. Простые (нейтральные липиды) – триглицериды. Номеклатура, состав, строение, их гидролиз.
- •40. Фосфатидная кислота. Её образование и гидролиз.
- •41.Фосфолипиды: фосфатидилсерины, фосфатидилэтаноламины и фосфатидилхолин (лецитины) – реакция гидролиза.
- •42.Стероиды: структура холестерина, желчных кислот.
- •43.Липидный состав мембран. Амфифильная природа мембранных липидов.
- •44.Классификация нуклеиновых кислот.
- •45.Пиримидиновые и пуриновые основания. Ароматические свойства. Лактим-тактамная таутометрия.
- •46.Нуклеозиды: номенклатура, строение, гидролиз.
- •47. Нуклеотиды: номенклатура, строение, гидролиз
- •48.Первичная структура нуклеиновых кислот: химический состав рнк и днк, типы химических связей.
- •49.Вторичная структура днк. Роль водородных связей в формировании вторичной структуры. Комплиментарные пары. Третичная структура днк.
- •50.Природные аминокислоты.Номенклатура и стереоизомерия.
- •51.Классификация аминокислот по: строению радикала, кислотно-основным свойствам.
- •52.Кислотно-основные свойства аминокислот, биполярная структура, изоэлектрическая точка.
- •53.Химические свойства α-аминокислот как гетерофункциональных соединений: реакции этерификации, ацилирования, алкилирования, образование иминов, реакция комплексообразования.
- •5,4. Биологические важные реакции α-аминокислот
- •55. Первичная структура белка. Строение пептидной группы. Гидролиз пептидов.
- •56. Вторичная, третичная, четвертичная структуры белка. Химические связи, участвующие в образовании структур белка. Биологическая роль структурной организации белковых молекул.
- •59. Миоглобин и гемоглобин: строение и функции.
- •60. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина (кооперативный эффект). Эффект Бора. Роль 2,3 – бисфосфоглицерата.
- •61. Особенности ферментов как белковых катализаторов. Активный центр, кофакторы и коферменты. Механизм действия ферментов. Этапы ферментативного катализа.
- •62. Классификация и номенклатура ферментов.
- •64. Зависимость активности ферментов от температуры и pH среды. Единицы активности ферментов.
- •65. Специфичность действия ферментов.
- •66. Аллостерические ферменты: структура, аллостерический и регуляторный центры. Гомо- и гетеротропные эффекты.
- •67. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное.
- •I. Обратимое ингибирование
- •68. Индукция и репрессия синтеза ферментов. Компартментация ферментов. (Нихуя не нашел толком. Говно, а не ответ)
- •69. Виды регуляции ферементов: ассоциация-диссоциация.
- •70. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
- •71. Применение ферментов и их ингибиторов в медицине (диагностика, лечение). Энзимопатии.
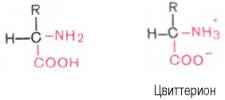
52.Кислотно-основные свойства аминокислот, биполярная структура, изоэлектрическая точка.
 Эти
свойства аминокислот определяют многие
физико-химические и биологические
свойства белков. На этих свойствах
основаны, кроме того, почти все методы
выделения и идентификации аминокислот.
Аминокислоты легко растворимы в воде.
Они кристаллизуются из нейтральных
водных растворов в форме биполярных
(амфотерных) ионов (цвиттерионов), а не
в виде недиссоциированных молекул
(последнюю структуру приводят для
удобства представления, однако все
аминокислоты при физиологических
значениях рН имеют структуру цвиттериона).
Эти
свойства аминокислот определяют многие
физико-химические и биологические
свойства белков. На этих свойствах
основаны, кроме того, почти все методы
выделения и идентификации аминокислот.
Аминокислоты легко растворимы в воде.
Они кристаллизуются из нейтральных
водных растворов в форме биполярных
(амфотерных) ионов (цвиттерионов), а не
в виде недиссоциированных молекул
(последнюю структуру приводят для
удобства представления, однако все
аминокислоты при физиологических
значениях рН имеют структуру цвиттериона).
 Изоэлектрическая
точка аминокислот, не содержащих
дополнительных NH2- или СООН-групп,
представляет собой среднее арифметическое
между двумя значениями рК'.
Изоэлектрическая
точка аминокислот, не содержащих
дополнительных NH2- или СООН-групп,
представляет собой среднее арифметическое
между двумя значениями рК'.
Изоэлектрическая точка ряда других аминокислот, содержащих дополнительные кислотные или основные группы, зависит, кроме того, от кислотности или основности радикалов этих аминокислот. Для лизина, например, рI должна вычисляться из полусуммы значений рК' для α- и ε-NН2-групп. Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов с протонированной аминогруппой и диссоциированной карбоксильной группой. Следует отметить, что при физиологических значениях рН тканей и крови (7,1 и 7,4 соответственно) аминокислоты (за ислючением гистидина) не обладают измеримой буферной емкостью. Эту способность они приобретают только при значениях рН, близких к величинам их рК (т.е. при рН 1,7-3,2 и 8,6-10,8).
53.Химические свойства α-аминокислот как гетерофункциональных соединений: реакции этерификации, ацилирования, алкилирования, образование иминов, реакция комплексообразования.
 Аминокислоты
являются амфотерными соединениями –
то есть они взаимодействуют и с кислотами
и с основаниями. При этом образуются
соли.
Аминокислоты
являются амфотерными соединениями –
то есть они взаимодействуют и с кислотами
и с основаниями. При этом образуются
соли.
 Реакция
ацилирования. Эта реакция является
реакцией ацильного нуклеофильного
замещения. Ацетилирование использовалось
для защиты аминогруппы в пептидном
синтезе.
Реакция
ацилирования. Эта реакция является
реакцией ацильного нуклеофильного
замещения. Ацетилирование использовалось
для защиты аминогруппы в пептидном
синтезе.
Реакции этерификации.


Алкилирование.
5,4. Биологические важные реакции α-аминокислот
Дезаминирование (удаление NH2 группы)
неокислительное (без участия кислорода):
окислительное (с участием ферментов дегидрогеназ и кофермента НАД+ или НАДФ+):
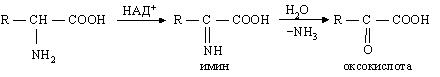
Трансаминирование.
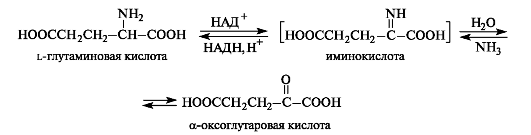
Это основной путь биосинтеза аминокислот из оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором — оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота — в аминокислоту с соответствующим строением радикалов. В итоге трансаминирование представляет собой обратимый процесс взаимообмена амино- и оксогрупп. Пример такой реакции — получение глутаминовой кислоты из оксоглутаровой кислоты. Донорной аминокислотой может служить, например, аспарагиновая кислота.
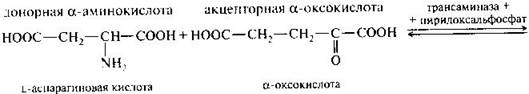
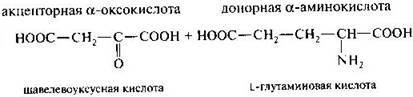
Обратимая реакция – аминирование.
Гидроксилирование
Например, ферментативное гидроксилирование фенилаланина:
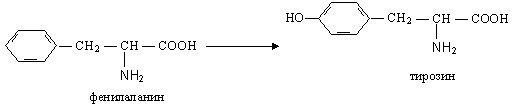
При генетически обусловленном отсутствии в организме фермента, катализирующего этот процесс, развивается тяжелое заболевание — фенилкетонурия
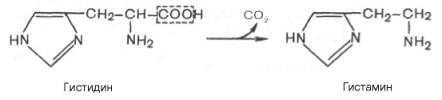
Декарбоксилирование – процесс отщепления карбоксильной группы аминокислот в виде СО2.
Несмотря на ограниченный круг аминокислот, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции – биогенные амины (гистамин, g-аминомасляная кислота, серотонин и др.) оказывают сильное фармакологическое действие на физиологические функции организма. Например, гистамин оказывает сосудорасширяющее действие, g-аминомасляная кислота оказывает тормозящее действие на ЦНС.
В живых организмах открыты 4 типа декарбоксилирования аминокислот. Для тканей животных характерно a-декарбоксилирование, при котором от аминокислот отщепляется карбоксильная группа, расположенная по соседству с a-углеродным атомом:
![]()
Продуктами реакции являются СО2 и биогенные амины.
Аминокислоты декарбоксилируются под действием ферментов декарбоксилаз при участи кофермента пиридоксальфосфата. При этом образуются биогенные амины.
 !
!
Биогенные амины обладают ярко выраженной биологической активностью. Важнейшими из них являются - коламин (предшественник в синтезе холина и нейромедиатора ацетилхолина), гистамин (обеспечивает аллергические реакции организма), -аминомасляная кислота (нейромедиатор), адреналин (гормон надпочечников, нейромедиатор)
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, простетическая группа которых представлена пиридоксальфосфатом, как и у аминотрансфераз. Таким образом, в двух совершенно различных процессах обмена участвует один и тот же кофермент.
Несмотря на ограниченный круг аминокислот, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции – биогенные амины (гистамин, g-аминомасляная кислота и др.) оказывают сильное фармакологическое действие на физиологические функции организма.
Гистамин образуется при декарбоксилировании гистидина, оказывает широкий спектр биологического действия: вызывает расширение капилляров (обладает сосудорасширяющим действием в отличие от других биогенных аминов), повышение их проницаемости (жидкость из крови выходит в межклеточную среду, что приводит к уменьшению объема крови), понижает АД, стимулирует секруцию желудочного сока и слюны, усиливает секрецию соляной кислоты в желудке; сокращает гладкие мышцы легких, что может вызвать «гистаминовый шок», что проявляется как приступ удушья; участвует в развитии болевых ощущений.
В
клинической практике широко используется,
кроме того, продукт α-декарбоксилирования
глутаминовой кислоты –
γ-аминомасляная кислота
(ГАМК). Фермент, катализирующий эту
реакцию (глутаматдекарбоксилаза),
является высокоспецифичным. Интерес к
ГАМК объясняется ее тормозящим действием
на деятельность ЦНС. Больше всего ГАМК
и глутаматдекарбоксилазы обнаружено
в сером веществе коры большого мозга,
в то время как белое вещество мозга и
периферическая нервная система их почти
не содержат. Введение ГАМК в организм
вызывает разлитой тормозной процесс в
коре (центральное торможение) и у животных
приводит к утрате условных рефлексов.
ГАМК используется в клинике как
лекарственное средство при некоторых
заболеваниях ЦНС, связанных с резким
возбуждением коры большого мозга. Так,
при эпилепсии хороший эффект (резкое
сокращение частоты эпилептических
припадков) дает введение глутаминовой
кислоты. Как оказалось, лечебный эффект
обусловлен не самой глутаминовой
кислотой, а продуктом ее декарбоксилирования
– ГАМК.
![]()
Триптофан – триптамин.
Окислительное дезаминирование глутаминвоой кислоты
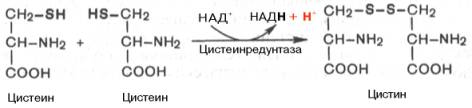
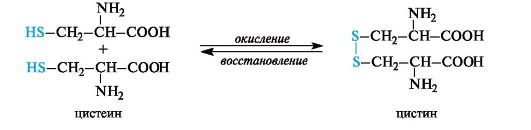
Окисление цистеина.