
- •5. Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
- •6. Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия.
- •8. Классификация дисперсных систем: по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой.
- •10. Осмос, осмотическое давление. Закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
- •11. Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
- •12. Факторы устойчивости коллоидных растворов. Механизм возникновения электрического заряда коллоидной частицы. Мицелла. Ядро. Гранула.
- •13. Ионное произведение воды. Методы определения pH растворов. Индикаторы.
- •Методы определения значения pH
- •14. Протолитические реакции. Понятия о кислотах и основаниях. Амфолиты. Ионизация слабых кислот и оснований. Константа кислотности и основности.
- •15. Буферные системы: определение, классификация, уравнение Гендерсона-Гассельбаха. Механизм действия буферных систем. Зона буферного действия и буферная емкость
- •16. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Взаимодействие буферных систем организма человека.
- •17. Понятие о кислотно-основном состоянии организма. Виды нарушений кос и способы коррекции.
- •18. Типы окислительно-восстановительных реакций, протекающих в организме.
- •19. Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий.
- •20. Классификация комплексных соединений, их строение. Представление о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины).
- •21. Типы изомерии органических соединений.
- •1.Структурная изомерия.
- •2.Пространственная изомерия.
- •22. Многоатомные спирты: этиленгликоль, глицерин, инозит. Их структура и функции. Образование сложных эфиров с неорганическими кислотами (нитроглицерин, фосфаты глицерина, инозита).
- •24. Аминофенолы: дофамин, норадреналин, адреналин. Понятие о биологической роли этих соединений и их производных.
- •26. Насыщенные дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая. Соли щавелевой кислоты- оксалаты.
- •27. Ненасыщенные дикарбоновые кислоты: фумаровая, малеиновая, их пространственное строение. Превращение янтарной кислоты в фумаровую как пример биологической реакции дегидрирования.
- •30. Классификация углеводов (моно-, олиго-, полисахариды). Моносахариды, их классификация (альдозы, кетозы).
- •31. Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.
- •34. Дисахариды: классификация (редуцирующие- мальтоза, целлобиоза, лактоза) и нередуцирующие (сахароза, трегалоза). Строение, химические свойства: гидролиз, окисление редуцирующих сахаров.
- •35. Классификация полисахаридов (гомо- и гетерополисахариды). Примеры.
- •36. Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза. Структура, типы, химических связей, гидролиз.
- •37. Липиды: определение, классификация.
- •39. Простые (нейтральные липиды) – триглицериды. Номеклатура, состав, строение, их гидролиз.
- •40. Фосфатидная кислота. Её образование и гидролиз.
- •41.Фосфолипиды: фосфатидилсерины, фосфатидилэтаноламины и фосфатидилхолин (лецитины) – реакция гидролиза.
- •42.Стероиды: структура холестерина, желчных кислот.
- •43.Липидный состав мембран. Амфифильная природа мембранных липидов.
- •44.Классификация нуклеиновых кислот.
- •45.Пиримидиновые и пуриновые основания. Ароматические свойства. Лактим-тактамная таутометрия.
- •46.Нуклеозиды: номенклатура, строение, гидролиз.
- •47. Нуклеотиды: номенклатура, строение, гидролиз
- •48.Первичная структура нуклеиновых кислот: химический состав рнк и днк, типы химических связей.
- •49.Вторичная структура днк. Роль водородных связей в формировании вторичной структуры. Комплиментарные пары. Третичная структура днк.
- •50.Природные аминокислоты.Номенклатура и стереоизомерия.
- •51.Классификация аминокислот по: строению радикала, кислотно-основным свойствам.
- •52.Кислотно-основные свойства аминокислот, биполярная структура, изоэлектрическая точка.
- •53.Химические свойства α-аминокислот как гетерофункциональных соединений: реакции этерификации, ацилирования, алкилирования, образование иминов, реакция комплексообразования.
- •5,4. Биологические важные реакции α-аминокислот
- •55. Первичная структура белка. Строение пептидной группы. Гидролиз пептидов.
- •56. Вторичная, третичная, четвертичная структуры белка. Химические связи, участвующие в образовании структур белка. Биологическая роль структурной организации белковых молекул.
- •59. Миоглобин и гемоглобин: строение и функции.
- •60. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина (кооперативный эффект). Эффект Бора. Роль 2,3 – бисфосфоглицерата.
- •61. Особенности ферментов как белковых катализаторов. Активный центр, кофакторы и коферменты. Механизм действия ферментов. Этапы ферментативного катализа.
- •62. Классификация и номенклатура ферментов.
- •64. Зависимость активности ферментов от температуры и pH среды. Единицы активности ферментов.
- •65. Специфичность действия ферментов.
- •66. Аллостерические ферменты: структура, аллостерический и регуляторный центры. Гомо- и гетеротропные эффекты.
- •67. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное.
- •I. Обратимое ингибирование
- •68. Индукция и репрессия синтеза ферментов. Компартментация ферментов. (Нихуя не нашел толком. Говно, а не ответ)
- •69. Виды регуляции ферементов: ассоциация-диссоциация.
- •70. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
- •71. Применение ферментов и их ингибиторов в медицине (диагностика, лечение). Энзимопатии.
27. Ненасыщенные дикарбоновые кислоты: фумаровая, малеиновая, их пространственное строение. Превращение янтарной кислоты в фумаровую как пример биологической реакции дегидрирования.
Непредельными дикарбоновыми кислотами называются органические соединения, содержащие в молекуле несколько карбоксильных групп СООН и ненасыщенные (двойные, тройные) связи.

Фумаровая кислота (Fumaric acid, E297) — химическое соединение с формулой HO2CCH=CHCO2H. Кристаллы имеют фруктовый вкус. Соли и эфиры называют фумаратами.
Фумаровая кислота обнаружена в растении аптечная дымянка, лишайниках и исландском мхе. Кожа человека образует фумарат при действии солнечного света. Фумарат также является побочным продуктом цикла мочевины.
Эфиры фумаровой кислоты применяют для лечения псориаза, дневная доза 60-105 мг, и повышается до 1300 мг в день.
Как подкислитель фумаровая кислота применяется в пищевой промышленности с 1946 года. Нетоксична. Обычно используется при приготовлении напитков и выпечки. Используется как заменитель винной кислоты и часто вместо лимонной кислоты (для достижения одинакового вкусового эффекта требуется 0,91 г фумарата вместо 1,36 г цитрата). Используется в леденцах как подкислитель, как и яблочная кислота.
Малеиновая кислота — органическое соединение с формулой HOОC-CH=CH-COОH. Название по номенклатуре IUPAC — цис-бутендиовая кислота. Ее транс-изомером является фумаровая кислота. Наиболее часто она используется для получения фумаровой кислоты.
Молекула малеиновой кислоты менее стабильна чем фумаровой кислоты. Разница их теплот сгорания равна 22.7 кДж/моль. Также малеиновая кислота хорошо растворима в воде (78.8г/л при 25 °C), а фумаровая кислота — плохо (6.3 г/л при 25 °C). Оба свойства объясняются образованием внутримолекулярных водородных связей в молекуле малеиновой кислоты.
Фумаровая
кислота содержится во многих растениях;
особенно часто она встречается в грибах.
Название ее происходит от растения
Fumaria officinalis (дымянка). Кроме того, фумаровая
кислота получается особым брожением
сахаристых веществ под действием
Aspergillus fumaricus. Малеиновая кислота в природе
не найдена. Обе кислоты обыкновенно
получаются при нагревании яблочной
кислоты:
![]()
Превращение янтарной кислоты в фумаровую кислоту является одной из реакций цикла трикарбоновых кислот (цикл Кребса). Происходит дегидрирование под действием сукцинатдегидрогеназы:

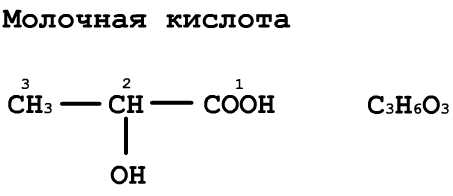
28. Гидроксикарбоновые кислоты: гликолевая, молочная, яблочная, лимонная, изолимонная, y-гидроксимасляная, в-гидроксимасляная. Химические свойства: реакции дегидратации, окисления, образования эфиров на примере молочной кислоты.
Гидроксикарбоновые кислоты – это органические соединения, в молекулах которых имеются и гидроксильная и карбоксильная группы.
Гликолевая кислота (гидроксиуксусная кислота, гидроксиэтановая кислота) — органическое соединение с химической формулой C2H4O3, простейшая гидроксикислота. Бесцветные кристаллы с запахом жженого сахара.
В природе содержится в винограде, сахарной свекле, сахарном тростнике. Хорошо растворяется в следующих жидкостях: воде, спирте, эфире.
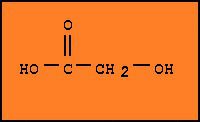
Молочная
кислота (α-оксипропионовая
кислота, 2-гидроксипропановая
кислота)
— карбоновая
кислота, имеющая формулу CH3CH(OH)COOH
и являющаяся конечным продуктом
анаэробного гликолиза игликогенолиза.
Реакция дегидратации молочной кислоты:

Примером биологического окисления может служить окисление молочной кислоты (кислота, содержащаяся в простокваше) — важного промежуточного вещества в реакциях обмена; эта реакция катализируется лактатдегидрогеназой.
Окисление
молочной кислоты представляет собой
реакцию дегидрирования, в которой при
помощи фермента от группировки ![]() ,
отщепляется два атома водорода.
,
отщепляется два атома водорода.
Образование сложного эфира:
СН3СН(ОН)СООН + С2Н5ОН --> СН3СН(ОН)СООС2Н5 + Н2О
Яблочная кислота представляет собой бесцветные кристаллы гигроскопического типа, которые растворяются в воде и подвергаются термальному воздействию. Впервые яблочная кислота была получена в 1785 году известным химиком из Швеции Карлом Шееле, который выделил кислоту из яблок.
Химическая формула C4H6O5.
Существуют два стереоизомера: D и L. В природе распространена L-яблочная кислота. Она содержится в кислых плодах, например в незрелых яблоках, крыжовнике, винограде, плодах рябины, в ревене, барбарисе, малине и др. Растения махорки и табака содержат её в виде солей никотина. Зрелые яблоки содержат примерно 0,35 % яблочной кислоты, незрелые — больше.
L-Яблочная кислота — один из важных промежуточных продуктов обмена веществ в живых организмах, образуется в организме в процессе трикарбонового цикла.
D-яблочную кислоту получают химически, восстановлением из D-винной кислоты. Продукты питания могут содержать как D-, так и L-изомер.

Лимо́нная кислота́ (2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) (C6H8O7) — кристаллическое вещество белого цвета, температура плавления 153 °C, хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Слабая трёхосновная кислота. Соли и эфиры лимонной кислоты называются цитратами.

Лимонная кислота, являясь главным промежуточным продуктом метаболического цикла трикарбоновых кислот, играет важную роль в системе биохимических реакций клеточного дыхания множества организмов.
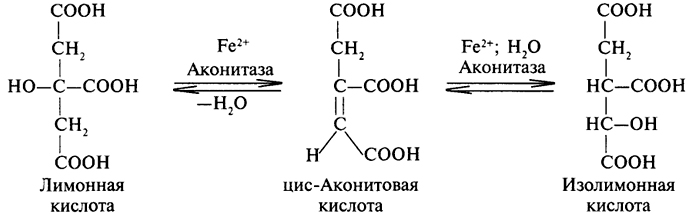
Изолимонная кислота- трикарбоновая оксикислота, изомер лимонной кислоты. В свободном состоянии обнаружена в растениях, особенно богаты ею суккуленты (бриофиллум и др.) и нек-рые плоды (напр., ежевики). В обмене веществ у животных, растений и микроорганизмов участвует в виде солей — изоцитратов — промежуточных продуктов цикла трикарбоновых к-т и гли-оксилатного цикла. В цикле трикарбоновых к-т изоцитрат образуется из цитрата. В растениях И. к. синтезируется также из акетоглутаровой к-ты путём темновой фиксации СО2.
Гамма-оксимасляная кислота (ГОМК, 4-гидроксибутановая кислота) — природная оксикислота, выполняющая важную роль в центральной нервной системе человека, а также встречающаяся в вине, цитрусовых и др. Гамма-оксимасляная кислота может применяться как анестетик и седативное средство, однако во многих странах она находится вне закона. Часто применяется в виде соли — оксибутирата натрия.
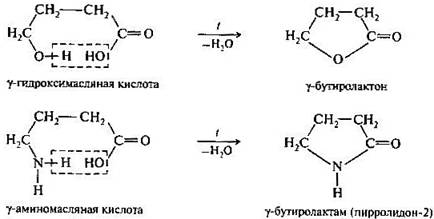
В-гидроксимасляная кислота как промежуточный продукт в-окисления жирных кислот накапливается в организме у больных сахарным диабетом, являясь в свою очередь предшественником ацетоуксусной кислоты. Формула: CH3CH(OH)CH2COOH.
В-гидроксимасляная кислота относится к кетоновым телам- группе продуктов обменаи в-в, образующихся в печени из Ацетил-Коа.
29. Оксокарбоновые кислоты: глиоксалевая, пировиноградная, щавеловоуксусная, в-оксомасляная, а-кетоглутаровая. Химические свойства: реакции восстановления, декарбоксилирования, кетольная таутомерия на примере пировиноградной кислоты.
Кетокислоты (оксокарбоновые кислоты)- органические соединения, одновременно содержащие карбоксильные и карбонильные группы; широко распространены в природе, играют важную роль в углеводном, белковом и жировом обмене.
Глиоксалевая кислота
или глиоксилевая, получается вместе с глиоксалем (см.), но удобнее получать ее из дихлор- или дибромуксусной кислоты при нагревании с водой в запаянной трубке при 220°:
CHCl2.СО2H + Н2О = СНО.СО2Н + 2HCl.
Это альдегидокислота, кристаллизующаяся в виде призм состава СНО.СО2Н.Н2О; она обладает всеми свойствами альдегида и одноосновной кислоты, при кипячении в щелочном растворе распадается на щавелевую и гликолевую кислоты:
2СОН.СО2Н + Н2О = CO2H.CO2H + СН2(ОН).СО2Н,
подобно тому как альдегиды в этих условиях дают спирт и кислоту.
Пировиноградная кислота (формула С3Н4O3) — α-кетопропионовая кислота. Бесцветная жидкость с запахом уксусной кислоты; растворима в воде, спирте и эфире. Используется обычно в виде солей — пируватов. Пировиноградная кислота содержится во всех тканях и органах и, являясь связующим звеном обмена углеводов, жиров и белков, играет важную роль в обмене веществ. Концентрация пировиноградной кислоты в тканях изменяется при болезнях печени, некоторых формах нефрита, раке, авитаминозах, особенно при недостатке витамина В1. Нарушение обмена пировиноградной кислоты приводит к ацетонурии.
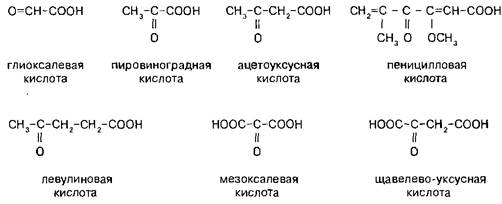
Пировиноградная кислота восстанавливается до молочной кислоты:
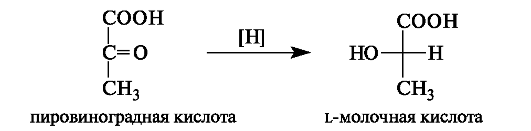
Декарбоксилирование
пировиноградной кислоты протекает в
присутствии фермента декарбоксилазы
и соответствующего кофермента.
Получающийся при этом ацетальдегид, не
теряя связи с коферментом («активный
ацетальдегид»), может присоединяться
к a- кетонокислотам, образуя
a-ацето-a-гидроксикислоты.
![]()
Оксалоацетат, щавелевоуксусная кислота (HO2C-C(O)-CH2-CO2H) — это четырехуглеродная двухосновная кетокислота. Существует в виде таутомера HO2C-C(OH)=CH-CO2H. Она образуется в цикле трикарбоновых кислот при окислении яблочной кислоты.
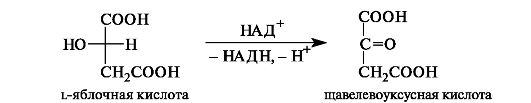
Ацетоýксусная
кислота -
одноосновная, первый представитель
β-кетокислот,
участвует в обмене
веществ.
Является неустойчивым соединением. В
свободном состоянии представляет
сиропообразную жидкость, уже при
комнатной температуре выделяющую
диоксид углеродая
Ацетоуксусная
кислота образуется в процессе метаболизма
ВЖК и как продукт окисления в-гидроксимасляной
кислоты наряду с продуктами ее превращений
накапливается в организме у больных
сахарным диабетом.

α-Кетоглутаровая кислота — одно из двух кетоновых производных глутаровой кислоты. Название «кетоглутаровая кислота» без дополнительных обозначений обычно означает альфа-форму. β-кетоглутаровая кислота отличается только положением кетонной функциональной группы и встречается гораздо реже.
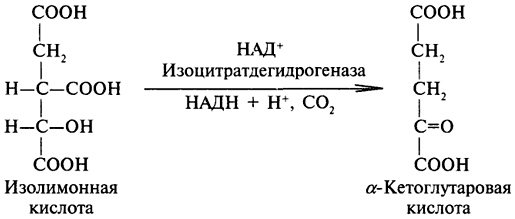
Цикл Кребса
α-кетоглутарат — ключевой продукт Кребса, образуется в результате декарбоксилирования изоцитрата и превращается в сукцинил-CoA в альфа-кетоглутарат дегидрогеназном комплексе. Анаплеротические реакции могут пополнять цикл на данном этапе путём синтеза α-кетоглутарата трансаминированием глутамата, или действием глутаматдегидрогеназы на глутамат.[2]
Синтез аминокислот
Глутамин синтезируется из глутамата с помощью фермента глутаминсинтетазы, которая на первой стадии образует глутамилфосфат, используя в качестве донора фосфата АТР; глутамин образуется в результате нуклеофильного замещения фосфата катионом аммония в глутамилфосфате, продуктами реакции являются глутамин и неорганический фосфат.[2]
Транспорт аммиака
Другой функцией альфа-кетоглутаровой кислоты является транспорт аммиака, выделяющегося в результате катаболизма аминокислот.[2]
α-кетоглутарат — один из важнейших переносчиков аммиака в метаболических путях. Аминогруппы от аминокислот прикрепляются к α-кетоглутарату в реакции трансаминирования и переносятся в печень, попадая в цикл мочевины.
