
- •5. Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
- •6. Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия.
- •8. Классификация дисперсных систем: по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой.
- •10. Осмос, осмотическое давление. Закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
- •11. Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
- •12. Факторы устойчивости коллоидных растворов. Механизм возникновения электрического заряда коллоидной частицы. Мицелла. Ядро. Гранула.
- •13. Ионное произведение воды. Методы определения pH растворов. Индикаторы.
- •Методы определения значения pH
- •14. Протолитические реакции. Понятия о кислотах и основаниях. Амфолиты. Ионизация слабых кислот и оснований. Константа кислотности и основности.
- •15. Буферные системы: определение, классификация, уравнение Гендерсона-Гассельбаха. Механизм действия буферных систем. Зона буферного действия и буферная емкость
- •16. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Взаимодействие буферных систем организма человека.
- •17. Понятие о кислотно-основном состоянии организма. Виды нарушений кос и способы коррекции.
- •18. Типы окислительно-восстановительных реакций, протекающих в организме.
- •19. Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий.
- •20. Классификация комплексных соединений, их строение. Представление о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины).
- •21. Типы изомерии органических соединений.
- •1.Структурная изомерия.
- •2.Пространственная изомерия.
- •22. Многоатомные спирты: этиленгликоль, глицерин, инозит. Их структура и функции. Образование сложных эфиров с неорганическими кислотами (нитроглицерин, фосфаты глицерина, инозита).
- •24. Аминофенолы: дофамин, норадреналин, адреналин. Понятие о биологической роли этих соединений и их производных.
- •26. Насыщенные дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая. Соли щавелевой кислоты- оксалаты.
- •27. Ненасыщенные дикарбоновые кислоты: фумаровая, малеиновая, их пространственное строение. Превращение янтарной кислоты в фумаровую как пример биологической реакции дегидрирования.
- •30. Классификация углеводов (моно-, олиго-, полисахариды). Моносахариды, их классификация (альдозы, кетозы).
- •31. Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.
- •34. Дисахариды: классификация (редуцирующие- мальтоза, целлобиоза, лактоза) и нередуцирующие (сахароза, трегалоза). Строение, химические свойства: гидролиз, окисление редуцирующих сахаров.
- •35. Классификация полисахаридов (гомо- и гетерополисахариды). Примеры.
- •36. Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза. Структура, типы, химических связей, гидролиз.
- •37. Липиды: определение, классификация.
- •39. Простые (нейтральные липиды) – триглицериды. Номеклатура, состав, строение, их гидролиз.
- •40. Фосфатидная кислота. Её образование и гидролиз.
- •41.Фосфолипиды: фосфатидилсерины, фосфатидилэтаноламины и фосфатидилхолин (лецитины) – реакция гидролиза.
- •42.Стероиды: структура холестерина, желчных кислот.
- •43.Липидный состав мембран. Амфифильная природа мембранных липидов.
- •44.Классификация нуклеиновых кислот.
- •45.Пиримидиновые и пуриновые основания. Ароматические свойства. Лактим-тактамная таутометрия.
- •46.Нуклеозиды: номенклатура, строение, гидролиз.
- •47. Нуклеотиды: номенклатура, строение, гидролиз
- •48.Первичная структура нуклеиновых кислот: химический состав рнк и днк, типы химических связей.
- •49.Вторичная структура днк. Роль водородных связей в формировании вторичной структуры. Комплиментарные пары. Третичная структура днк.
- •50.Природные аминокислоты.Номенклатура и стереоизомерия.
- •51.Классификация аминокислот по: строению радикала, кислотно-основным свойствам.
- •52.Кислотно-основные свойства аминокислот, биполярная структура, изоэлектрическая точка.
- •53.Химические свойства α-аминокислот как гетерофункциональных соединений: реакции этерификации, ацилирования, алкилирования, образование иминов, реакция комплексообразования.
- •5,4. Биологические важные реакции α-аминокислот
- •55. Первичная структура белка. Строение пептидной группы. Гидролиз пептидов.
- •56. Вторичная, третичная, четвертичная структуры белка. Химические связи, участвующие в образовании структур белка. Биологическая роль структурной организации белковых молекул.
- •59. Миоглобин и гемоглобин: строение и функции.
- •60. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина (кооперативный эффект). Эффект Бора. Роль 2,3 – бисфосфоглицерата.
- •61. Особенности ферментов как белковых катализаторов. Активный центр, кофакторы и коферменты. Механизм действия ферментов. Этапы ферментативного катализа.
- •62. Классификация и номенклатура ферментов.
- •64. Зависимость активности ферментов от температуры и pH среды. Единицы активности ферментов.
- •65. Специфичность действия ферментов.
- •66. Аллостерические ферменты: структура, аллостерический и регуляторный центры. Гомо- и гетеротропные эффекты.
- •67. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное.
- •I. Обратимое ингибирование
- •68. Индукция и репрессия синтеза ферментов. Компартментация ферментов. (Нихуя не нашел толком. Говно, а не ответ)
- •69. Виды регуляции ферементов: ассоциация-диссоциация.
- •70. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
- •71. Применение ферментов и их ингибиторов в медицине (диагностика, лечение). Энзимопатии.
26. Насыщенные дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая. Соли щавелевой кислоты- оксалаты.
Двухосновные предельные карбоновые кислоты (двухосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с двумя карбоксильными группами –COOH. Все они имеют общую формулу HOOC(CH2)nCOOH, где n = 0, 1, 2, …
Щаве́левая кислота (этандиовая кислота) НООССООН — двухосновная предельная карбоновая кислота. Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры щавелевой кислоты называются оксалатами. В природе содержится в щавеле, ревене, карамболе и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция.
В организме щавелевая кислота является промежуточным продуктом обмена веществ, выделяется с мочой в виде солей кальция. При нарушениях минерального обмена соли щавелевой кислоты (оксалаты) участвуют в образовании камней в почках и мочевом пузыре.
Получение:
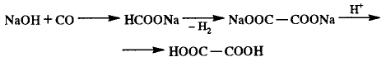
Мало́новая
кислота (пропандиовая,
метандикарбоновая кислота)
НООССН2СООН —
двухосновная предельная карбоновая
кислота.
Обладает всеми химическими свойствами,
 характерными
для карбоновых
кислот. Соли и сложные
эфиры малоновой
кислоты называются малонатами.
Малонат кальция содержится в соке сахарной
свёклы.
характерными
для карбоновых
кислот. Соли и сложные
эфиры малоновой
кислоты называются малонатами.
Малонат кальция содержится в соке сахарной
свёклы.
Малоновая кислота хорошо растворима в воде и этаноле, а также в пиридине и диэтиловом эфире. В бензоле малоновая кислота не растворяется.
Щелочные соли малоновой кислоты хорошо растворяются в воде, в отличие от малонатов свинца и бария.
Малоновая кислота образует два ряда производных по карбоксильным группам (кислых и полных): сложные эфиры, нитрилы, амиды, хлорангидриды. Например, в зависимости от условий проведения реакции при действии на малоновую кислоту SOCl2 образуется полный хлорангидрид ClCOCH2COCl или полухлорангидрид ClCOCH2COOH.
При нагревании кислоты выше температуры плавления или нагревания её водного раствора выше 70 °C малоновая кислота легко декарбоксилируется с образованием уксусной кислоты. Декарбоксилированию подвергаются также замещённые малоновые кислоты, которые превращаются в монокарбоновые кислоты: RCH(COOH)2 → RCH2COOH + CO2.
При нагревании с оксидом фосфора(V) малоновая кислота образует недооксид углерода C3O2. Под действием брома переходит в броммалоновую или диброммалоновую кислоту; при действии HNO2окисляется до мезоксалевой кислоты OC(COOH)2.
Янтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота) — двухосновная предельная карбоновая кислота. Бесцветные кристаллы, растворимые в воде и спирте. Содержится в небольших количествах во многих растениях, янтаре.
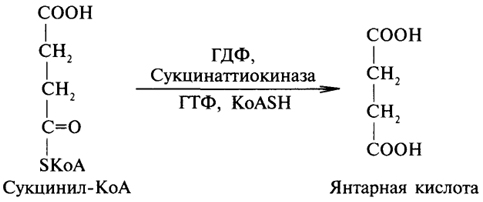
Метиленовые группы янтарной кислоты обладают высокой реакционной способностью, что связано с влиянием карбоксильных групп. При бромировании янтарная кислота даёт дибромянтарную кислоту HOOC—(CHBr)2—COOH. Диэфиры янтарной кислоты конденсируются с кетонами (конденсация Штоббе) и с альдегидами.
С аммиаком и аминами янтарная кислота образует сукцинимид и его N-замещённые аналоги (R-H, алкильная или арильная группа). Моно- и диамиды янтарной кислоты, получаемые с ароматическими и гетероциклическими аминами, применяют для синтеза некоторых красителей, инсектицидов и лекарственных веществ.
Янтарная кислота и её ангидрид легко вступают в реакцию Фриделя-Крафтса с ароматическими соединениями (так называемое сукцинилирование), образуя производные 4-арил-4-кетомасляной кислоты.
Янтарная кислота участвует в процессе клеточного дыхания кислорододышащих организмов.
Глутаровая кислота (Пентандиовая кислота) — двухосновная предельная карбоновая кислота.
Обладает достаточно высокой растворимостью в воде, по сравнению с адипиновой кислотой.
Используется в производстве полимеров, типа полиэстера и полиамидов.
Кето-производное глутаровой кислоты — α-кетоглутаровая кислота (α-кетоглутарат) является важным биологическим соединением. Эта кетокислота образуется при дезаминировании глутамата, и является одним из промежуточных продуктов цикла Кребса.
Оксалаты — соли и эфиры щавелевой кислоты. Соли содержат в своём составе дианион (оксалат) C2O42− или (COO)22−, образующийся при двойном депротонировании щавелевой кислоты.
Свойства солей
Большинство солей оксалатов плохо растворимо в воде, например, оксалат кальция, который используется для обнаружения кальция. Хорошо растворимы оксалат калия и аммония.
Оксалаты проявляют восстановительные свойства. Так его концентрацию в растворе можно определить титрованием перманганатом калия тёплого раствора. Реакция автокаталитическая.
![]()
Оксалаты распадаются при нагревании, однако продукты могут быть разными в зависимости от металла и условий.
активные
металлы ![]()
неактивные
металлы ![]()
Комплексообразование
Анион оксалата может выступать в качестве бидентатного лиганда, образуя пятичленный цикл — MO2C2, как например, в ферриоксалате калия — K3[Fe(C2O4)3]. Благодаря его хорошей растворимости щавелевая кислота используется для удаления ржавчины.
Оксалаты широко распространены в природе, например, в щавеле, кислице. Корни и/или листья ревеня, гречихи содержат щавелевую кислоту. Накопление щавелевой кислоты происходит из-за неполного окисления углеводов в процессе биосинтеза.
Следующие съедобные растения содержат оксалаты в порядке уменьшения концентрации: карамбола, чёрный перец, петрушка, семена мака, щирица, шпинат, мангольд, сахарная свекла, какао, шоколад, большинство орехов и ягод, фасоль.
Листья чайного куста содержат большое относительное количество оксалатов по отношению к другим растениям. Обычно его экстракты содержат от малых до средних концентраций оксалатов благодаря малой массе используемых листьев.
