
- •5. Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
- •6. Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия.
- •8. Классификация дисперсных систем: по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой.
- •10. Осмос, осмотическое давление. Закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
- •11. Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
- •12. Факторы устойчивости коллоидных растворов. Механизм возникновения электрического заряда коллоидной частицы. Мицелла. Ядро. Гранула.
- •13. Ионное произведение воды. Методы определения pH растворов. Индикаторы.
- •Методы определения значения pH
- •14. Протолитические реакции. Понятия о кислотах и основаниях. Амфолиты. Ионизация слабых кислот и оснований. Константа кислотности и основности.
- •15. Буферные системы: определение, классификация, уравнение Гендерсона-Гассельбаха. Механизм действия буферных систем. Зона буферного действия и буферная емкость
- •16. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Взаимодействие буферных систем организма человека.
- •17. Понятие о кислотно-основном состоянии организма. Виды нарушений кос и способы коррекции.
- •18. Типы окислительно-восстановительных реакций, протекающих в организме.
- •19. Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий.
- •20. Классификация комплексных соединений, их строение. Представление о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины).
- •21. Типы изомерии органических соединений.
- •1.Структурная изомерия.
- •2.Пространственная изомерия.
- •22. Многоатомные спирты: этиленгликоль, глицерин, инозит. Их структура и функции. Образование сложных эфиров с неорганическими кислотами (нитроглицерин, фосфаты глицерина, инозита).
- •24. Аминофенолы: дофамин, норадреналин, адреналин. Понятие о биологической роли этих соединений и их производных.
- •26. Насыщенные дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая. Соли щавелевой кислоты- оксалаты.
- •27. Ненасыщенные дикарбоновые кислоты: фумаровая, малеиновая, их пространственное строение. Превращение янтарной кислоты в фумаровую как пример биологической реакции дегидрирования.
- •30. Классификация углеводов (моно-, олиго-, полисахариды). Моносахариды, их классификация (альдозы, кетозы).
- •31. Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.
- •34. Дисахариды: классификация (редуцирующие- мальтоза, целлобиоза, лактоза) и нередуцирующие (сахароза, трегалоза). Строение, химические свойства: гидролиз, окисление редуцирующих сахаров.
- •35. Классификация полисахаридов (гомо- и гетерополисахариды). Примеры.
- •36. Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза. Структура, типы, химических связей, гидролиз.
- •37. Липиды: определение, классификация.
- •39. Простые (нейтральные липиды) – триглицериды. Номеклатура, состав, строение, их гидролиз.
- •40. Фосфатидная кислота. Её образование и гидролиз.
- •41.Фосфолипиды: фосфатидилсерины, фосфатидилэтаноламины и фосфатидилхолин (лецитины) – реакция гидролиза.
- •42.Стероиды: структура холестерина, желчных кислот.
- •43.Липидный состав мембран. Амфифильная природа мембранных липидов.
- •44.Классификация нуклеиновых кислот.
- •45.Пиримидиновые и пуриновые основания. Ароматические свойства. Лактим-тактамная таутометрия.
- •46.Нуклеозиды: номенклатура, строение, гидролиз.
- •47. Нуклеотиды: номенклатура, строение, гидролиз
- •48.Первичная структура нуклеиновых кислот: химический состав рнк и днк, типы химических связей.
- •49.Вторичная структура днк. Роль водородных связей в формировании вторичной структуры. Комплиментарные пары. Третичная структура днк.
- •50.Природные аминокислоты.Номенклатура и стереоизомерия.
- •51.Классификация аминокислот по: строению радикала, кислотно-основным свойствам.
- •52.Кислотно-основные свойства аминокислот, биполярная структура, изоэлектрическая точка.
- •53.Химические свойства α-аминокислот как гетерофункциональных соединений: реакции этерификации, ацилирования, алкилирования, образование иминов, реакция комплексообразования.
- •5,4. Биологические важные реакции α-аминокислот
- •55. Первичная структура белка. Строение пептидной группы. Гидролиз пептидов.
- •56. Вторичная, третичная, четвертичная структуры белка. Химические связи, участвующие в образовании структур белка. Биологическая роль структурной организации белковых молекул.
- •59. Миоглобин и гемоглобин: строение и функции.
- •60. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина (кооперативный эффект). Эффект Бора. Роль 2,3 – бисфосфоглицерата.
- •61. Особенности ферментов как белковых катализаторов. Активный центр, кофакторы и коферменты. Механизм действия ферментов. Этапы ферментативного катализа.
- •62. Классификация и номенклатура ферментов.
- •64. Зависимость активности ферментов от температуры и pH среды. Единицы активности ферментов.
- •65. Специфичность действия ферментов.
- •66. Аллостерические ферменты: структура, аллостерический и регуляторный центры. Гомо- и гетеротропные эффекты.
- •67. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное.
- •I. Обратимое ингибирование
- •68. Индукция и репрессия синтеза ферментов. Компартментация ферментов. (Нихуя не нашел толком. Говно, а не ответ)
- •69. Виды регуляции ферементов: ассоциация-диссоциация.
- •70. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
- •71. Применение ферментов и их ингибиторов в медицине (диагностика, лечение). Энзимопатии.
21. Типы изомерии органических соединений.
Изомерия — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Различают структурную и пространственную изомерию (стереоизомерию).
1.Структурная изомерия.
А. Изомерия углеродной цепи (углеродного скелета)
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3—СН2—СН2—СН3 и изобутан (СН3)3СН. Другие примеры: антрацен и фенантрен(формулы I и II, соответственно), циклобутан и метилциклопропан (III и IV).
Б. Валентная изомерия
Валентная — особый вид структурной изомерии, при которой изомеры можно перевести друг в друга лишь за счёт перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен (VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»), бензвален (VIII).
В. Изомерия функциональной группы (межклассовая изомерия)
Различается характером функциональной группы; например, этанол (CH3—CH2—OH) и диметиловый эфир (CH3—O—CH3).
Г. Изомерия положения
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота
2.Пространственная изомерия.
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение.
А. оптическая изомерия)
Оптическими изомерами - являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств Чаще всего речь идет об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями.
Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серыи9
Б. Диастереомерия
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры.
σ—диастереомерия
σ-диастереомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастереомерами являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
π—диастереомерия (геометрическая изомерия)
π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
22. Многоатомные спирты: этиленгликоль, глицерин, инозит. Их структура и функции. Образование сложных эфиров с неорганическими кислотами (нитроглицерин, фосфаты глицерина, инозита).
1.Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
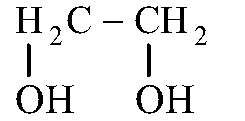
Этиленгликоль действует как сосудистый и протоплазматический яд, подавляет окислительные процессы, вызывает отек, набухание и некроз мелких сосудов, нарушает тканевое кровообращение, сдвигает кислотно-щелочное состояние в сторону метаболического ацидоза, нарушает водно-электролитный баланс.
2. Глицери́н (1,2,3-триоксипропан, пропантриол-1,2,3) — простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость.
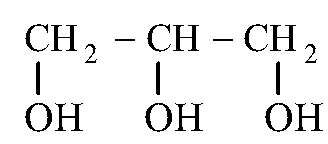
Функции: структурная и энергетическая.
3. Инозитол (циклогексан-1,2,3,4,5,6-гексол) — шестиатомный спирт циклогексана. Инозитол существует в девяти стереоизомерах, из которых наиболее часто встречающимся в живых организмах является цис-1,2,3,5-транс-4,6-циклогексангексол. Несмотря на сходную с сахаридами брутто-формулу Cx(H2O)y, инозитол по химической природе не является углеводом, он практически безвкусный, слегка сладкий.

В организме выполняет функции:
Учавствует в биосинтезе фосфолипидов
Участник метаболизма пуринов.
Влияние на холестериновый обмен.
Стимуляция обмена углеводов.
Образование нитроглицерина.

Образование фосфатов глицерина.
Глицерофосфаты- структурные элементы фосфолипидов
В результате действия фосфорной кислоты на глицерин получают смесь альфа- и бета-глицерофосфатов.
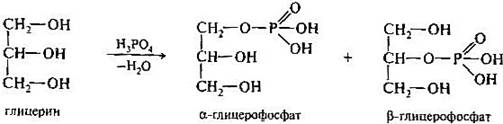
Фосфаты инозита.
Янинашол(
23. Полиамины: этилендиамин, путресцин. Аминоспирты: аминоэтанол (коламин), холин, ацетилхолин.
Этилендиамин (1,2-диаминоэтан)H2NCH2CH2NH2 — органическое соединение класса аминов.
Жидкость без цвета с запахом аммиака, испаряется при контакте с влажным воздухом. tkип 116,5 °C, tпл 8,5 °C, плотность 0,899 г/см³ (20 °C); Этилендиамин хорошо растворяется в воде (с разогреванием раствора), этаноле, хуже — в эфире, нерастворим в бензоле и других углеводородах. Является сильным основанием.
Имея в своей молекуле две аминогруппы, образует с кислотами два ряда солей. С некоторыми металлами (например, Cu, Mn, Co) образует комплексные соединения.
Динитрат этилендиамина при нагревании превращается в этилендинитрамин, являющийся взрывчатым веществом:
![]()
Вступает в реакции конденсации: при повышенных температурах и давлении и присутствии катализаторов превращается в пиперазин; при конденсации с 1,2-дикетонами - 2,3-дигидропиразинами; при реакции с мочевиной - этиленмочевину (2-имидазолининон).
Применяется в органическом синтезе при получении гербицида цинеб; совместно с другими аминами как отвердитель для эпоксидных смол. Соли этилендиамина и жирных кислот используются в текстильной промышленности как смягчающие агенты.
Получается при взаимодействии дихлорэтана с водным раствором аммиака с последующей ректификацией.
![]()
Путресцин-
токсическое вещество из группы полиаминов, представляющее собой диамин, образующийся в толстой кишке при ферментативном декарбоксилировании орнитина; при цистинурии обнаруживается в моче.
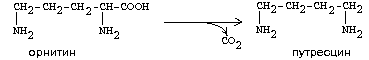
Бесцветное кристаллическое вещество с чрезвычайно неприятным запахом, плохо растворимое в воде, имеет низкую темперературу плавления (tпл= 27—28 °C), является сильным основанием.
Этаноламин HO-CH2CH2-NH2 (2-аминоэтанол, тривиальное название коламин) — простейший стабильный аминоспирт, вязкая маслянистая жидкость, смешивается с водой во всех отношениях, слабое основание.
Получение
Этаноламин получают действием аммиака на этиленхлоргидрин (2-хлорэтанол):
![]()
В промышленности синтез этаноламина проводится присоединением аммиака к этиленоксиду:
![]()
Наряду с моноэтаноламином при этом получаются диэтаноламин и триэтаноламин
![]()
Холи́н (от греч. χολή — жёлчь) — гидроксид 2-оксиэтилтриметиламмония, [(CH3)3N+CH2CH2OH] OH−.
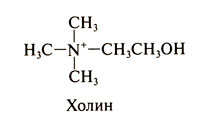
Холин представляет собой очень гигроскопичные бесцветные кристаллы, хорошо растворимые в воде, этаноле, хуже растворимые в амиловом спирте, ацетоне и хлороформе, нерастворимые в диэтиловом эфире, сероуглероде, четырёххлористом углероде, бензоле.
Разбавленные растворы холина стабильны при температурах до 70°С.
Холин является сильным основанием (pKb=5,06), способен вытеснять аммиак из его солей и легко образует соли с сильными кислотами.
Биохимия и физиологические функции холина
В организме из холина синтезируется важнейший нейромедиатор-передатчик нервного импульса — ацетилхолин. Холин является важным веществом для нервной системы и улучшает память.
Входит в состав фосфолипидов (например, лецитина, сфингомиелина).
Участвует в синтезе аминокислоты метионин, где является поставщиком метильных групп.
Влияет на углеводный обмен, регулируя уровень инсулина в организме.
Холин является гепатопротектором и липотропным средством. В комплексе с лецитином способствует транспорту и обмену жиров в печени.
Отсутствие холина в пище приводит к отложению жира в печени, поражению почек и кровотечениям.
Применение
Холин необходим для лечения заболеваний печени и при атеросклерозе.
В медицине для лечения заболеваний печени применяют хлорид холина. Его вводят также в состав комбикормов сельскохозяйственным животных. Для аналитических целей используют способность холина давать плохо растворимые соли сфосфорновольфрамовой, платинохлористоводородной и некоторыми др. гетерополикислотами.
Холин, его соли и эфиры зарегистрированы в качестве пищевой добавки E1001.
Ацетилхолин
(лат. Acetylcholinum) — медиатор нервной системы,
биогенный амин, относящийся к веществам,
образующимся в организме. Ацетилхолину
принадлежит важная роль как медиатору
центральной нервной системы. Он участвует
в передаче импульсов в разных отделах
мозга, при этом малые концентрации
облегчают, а большие — тормозят
синаптическую передачу. Изменения в
обмене ацетилхолина могут привести к
нарушению функций мозга. Ацетилхолин
является посредником передачи нервного
импульса к мышце. При недостатке
ацетилхолина снижается сила сокращений
мышц. Окончания нервных волокон, для
которых он служит медиатором, называются
холинергическими, а рецепторы,
взаимодействующие с ним, называют
холинорецепторами. Холинорецепторы
постганглионарных холинергических
нервов (сердца, гладких мышц, желез)
обозначают как м-холинорецепторы
(мускариночувствительные), а расположенные
в области ганглионарных синапсов и в
соматических нервномышечных синапсах
— как н-холинорецепторы
(никотиночувствительнные). Такое деление
связано с особенностями реакций,
возникающих при взаимодействии
ацетилхолина с этими биохимическими
системами: мускариноподобных в первом
случае и никотиноподобных — во втором;
м- и н-холинорецепторы находятся также
в разных отделах ЦНС.

