
- •5. Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
- •6. Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия.
- •8. Классификация дисперсных систем: по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой.
- •10. Осмос, осмотическое давление. Закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
- •11. Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
- •12. Факторы устойчивости коллоидных растворов. Механизм возникновения электрического заряда коллоидной частицы. Мицелла. Ядро. Гранула.
- •13. Ионное произведение воды. Методы определения pH растворов. Индикаторы.
- •Методы определения значения pH
- •14. Протолитические реакции. Понятия о кислотах и основаниях. Амфолиты. Ионизация слабых кислот и оснований. Константа кислотности и основности.
- •15. Буферные системы: определение, классификация, уравнение Гендерсона-Гассельбаха. Механизм действия буферных систем. Зона буферного действия и буферная емкость
- •16. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Взаимодействие буферных систем организма человека.
- •17. Понятие о кислотно-основном состоянии организма. Виды нарушений кос и способы коррекции.
- •18. Типы окислительно-восстановительных реакций, протекающих в организме.
- •19. Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий.
- •20. Классификация комплексных соединений, их строение. Представление о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины).
- •21. Типы изомерии органических соединений.
- •1.Структурная изомерия.
- •2.Пространственная изомерия.
- •22. Многоатомные спирты: этиленгликоль, глицерин, инозит. Их структура и функции. Образование сложных эфиров с неорганическими кислотами (нитроглицерин, фосфаты глицерина, инозита).
- •24. Аминофенолы: дофамин, норадреналин, адреналин. Понятие о биологической роли этих соединений и их производных.
- •26. Насыщенные дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая. Соли щавелевой кислоты- оксалаты.
- •27. Ненасыщенные дикарбоновые кислоты: фумаровая, малеиновая, их пространственное строение. Превращение янтарной кислоты в фумаровую как пример биологической реакции дегидрирования.
- •30. Классификация углеводов (моно-, олиго-, полисахариды). Моносахариды, их классификация (альдозы, кетозы).
- •31. Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.
- •34. Дисахариды: классификация (редуцирующие- мальтоза, целлобиоза, лактоза) и нередуцирующие (сахароза, трегалоза). Строение, химические свойства: гидролиз, окисление редуцирующих сахаров.
- •35. Классификация полисахаридов (гомо- и гетерополисахариды). Примеры.
- •36. Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза. Структура, типы, химических связей, гидролиз.
- •37. Липиды: определение, классификация.
- •39. Простые (нейтральные липиды) – триглицериды. Номеклатура, состав, строение, их гидролиз.
- •40. Фосфатидная кислота. Её образование и гидролиз.
- •41.Фосфолипиды: фосфатидилсерины, фосфатидилэтаноламины и фосфатидилхолин (лецитины) – реакция гидролиза.
- •42.Стероиды: структура холестерина, желчных кислот.
- •43.Липидный состав мембран. Амфифильная природа мембранных липидов.
- •44.Классификация нуклеиновых кислот.
- •45.Пиримидиновые и пуриновые основания. Ароматические свойства. Лактим-тактамная таутометрия.
- •46.Нуклеозиды: номенклатура, строение, гидролиз.
- •47. Нуклеотиды: номенклатура, строение, гидролиз
- •48.Первичная структура нуклеиновых кислот: химический состав рнк и днк, типы химических связей.
- •49.Вторичная структура днк. Роль водородных связей в формировании вторичной структуры. Комплиментарные пары. Третичная структура днк.
- •50.Природные аминокислоты.Номенклатура и стереоизомерия.
- •51.Классификация аминокислот по: строению радикала, кислотно-основным свойствам.
- •52.Кислотно-основные свойства аминокислот, биполярная структура, изоэлектрическая точка.
- •53.Химические свойства α-аминокислот как гетерофункциональных соединений: реакции этерификации, ацилирования, алкилирования, образование иминов, реакция комплексообразования.
- •5,4. Биологические важные реакции α-аминокислот
- •55. Первичная структура белка. Строение пептидной группы. Гидролиз пептидов.
- •56. Вторичная, третичная, четвертичная структуры белка. Химические связи, участвующие в образовании структур белка. Биологическая роль структурной организации белковых молекул.
- •59. Миоглобин и гемоглобин: строение и функции.
- •60. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина (кооперативный эффект). Эффект Бора. Роль 2,3 – бисфосфоглицерата.
- •61. Особенности ферментов как белковых катализаторов. Активный центр, кофакторы и коферменты. Механизм действия ферментов. Этапы ферментативного катализа.
- •62. Классификация и номенклатура ферментов.
- •64. Зависимость активности ферментов от температуры и pH среды. Единицы активности ферментов.
- •65. Специфичность действия ферментов.
- •66. Аллостерические ферменты: структура, аллостерический и регуляторный центры. Гомо- и гетеротропные эффекты.
- •67. Ингибирование активности ферментов: обратимое, необратимое, конкурентное, неконкурентное.
- •I. Обратимое ингибирование
- •68. Индукция и репрессия синтеза ферментов. Компартментация ферментов. (Нихуя не нашел толком. Говно, а не ответ)
- •69. Виды регуляции ферементов: ассоциация-диссоциация.
- •70. Ковалентная модификация ферментов: ограниченный протеолиз проферментов, фосфорилирование и дефосфорилирование.
- •71. Применение ферментов и их ингибиторов в медицине (диагностика, лечение). Энзимопатии.
1. Термодинамические системы: определение, классификация: систем (изолированные, закрытые, открытые) и процессов (изотермические, изобарные, изохорные). Стандартное состояние. Основные понятия термодинамики: внутренняя энергия, работа, теплота.
Термодинамические системы - совокупности физических тел, которые могут взаимодействовать энергетически между собой и с другими телами, а также обмениваться с ними веществом. Системы:
а) Система открытая, если возможен энергообмен и обмен веществом.
б) Система закрытая, если энергообмен возможен, а обмен веществом невозможен.
в) Система изолированная, если невозможен какой-либо обмен системы с окружающей средой
Процессы:
а) Изотермический процесс — происходящий при постоянной температуре б) Изобарный процесс — происходящий при постоянном давлении в) Изохорный процесс — происходящий при постоянном объёме
Стандартное состояние - это состояние системы, условно выбранное в качестве стандарта для сравнения.
Для газовой фазы — это состояние химически чистого вещества в газовой фазе под стандартным давлением 100 кПа, подразумевая наличие свойств идеального газа.
Для беспримесной фазы, смеси или растворителя в жидком или твёрдом агрегатном состоянии — это состояние химически чистого вещества в жидкой или твёрдой фазе под стандартным давлением.
Для раствора — это состояние растворённого вещества со стандартной моляльностью 1 моль/кг, под стандартным давлением или стандартной концентрации, исходя из условий, что раствор неограниченно разбавлен.
Для химически чистого вещества — это вещество в чётко определённом агрегатном состоянии под чётко определённым, но произвольным, стандартным давлением.
В определение стандартного состояния не входит стандартная температура, хотя часто говорят о стандартной температуре, которая равна 25 °C (298,15 К).
Внутренняя энергия – это суммарная энергия всех составных частей системы и их взаимодействий.
работа — энергия предающаяся за счёт упорядоченного поступательного движения потока элементов системы или окружающей среды
теплота-энергия передающаяся за счёт хаотического движения элементов системы и окружающей среды. Внутренняя энергия термодинамической системы может изменяться двумя способами: посредством совершения работы над системой и посредством теплообмена с окружающей средой. Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется количеством теплоты или просто теплотой
2. Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции. Применение первого начала термодинамики к биосистемам.
Первое начало термодинамики —закон сохранения энергии для термодинамических систем.
количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами:
Q = ΔU + A.
В
изохорном процессе газ работы не
совершает, и ΔU = Q. В изобарном процессе
A = p (V2 – V1). В изотермическом процессе
ΔU = 0, и A = Q; вся теплота, переданная телу,
идет на работу над внешними телами.
Графически работа равна площади под
кривой процесса на плоскости p, V.
 - первое начало термодинамики для
изохорного процесса
- первое начало термодинамики для
изохорного процесса
 - первое начало термодинамики для
изобарного проце
- первое начало термодинамики для
изобарного проце - первое начало термодинамики для
изотермического процесса
- первое начало термодинамики для
изотермического процесса
энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении
стандартной теплотой образования -тепловой эффект реакции образования одного моль вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 74.9 кДж/моль.
Стандартная
энтальпия образования обозначается
ΔHfO.
перечеркнутый кружок, то, что величина
относится к стандартному состоянию
вещества.
Стандартная энтальпия сгорания — ΔHгоро, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Первое начало термодинамики для биологических систем: Поступление пищи обеспечивает энергию, которая используется для выполнения различных функций организма или сохраняется для последующего использования. Энергия высвобождается из пищевых продуктов в процессе их биологического окисления, которое является многоступенчатым процессом. Энергия пищевых продуктов используется в клетках первоначально для синтеза макроэргических соединений - например, аденозинтрифосфорной кислоты (ATФ). ATФ, в свою очередь, может использоваться как источник энергии почти для всех процессов в клетке. Пищевые вещества окисляются вплоть до конечных продуктов, которые выделяются из организма. Например, углеводы окисляются в организме до углекислого газа и воды. Такие же конечные продукты образуются при сжигании углеводов в калориметре: C6H12O6 + 6O2 = 6CO2 + 6H2O Величина энергии, высвобождаемой из каждого грамма глюкозы в этой реакции, составляет 4,1 килокалории (кКал). Столько же энергии, образуется при окислении глюкозы в живых клетках, несмотря на то, что процесс окисления в них является многоступенчатым процессом и происходит в несколько стадий. Этот вывод основан на принципе Гесса, который является следствием первого закона термодинамики: тепловой эффект многоступенчатого химического процесса не зависит от его промежуточных этапов, а определяется лишь начальным и конечным состояниями системы. Таким образом, исследования с помощью калориметра показали среднюю величину физиологически доступной энергии, которая содержится в 1грамме трех пищевых продуктов (в килокалориях): углеводы - 4,1; белки - 4,1; жиры - 9,3. С другой стороны, в конечном итоге вся энергия, поступившая в организм, превращается в теплоту. Также при образовании АТФ лишь часть энергии запасается, большая - рассеивается в форме тепла. При использовании энергии ATФ функциональными системами организма большая часть этой энергии также переходит в тепловую. Оставшаяся часть энергии в клетках идёт на выполнении ими функции, однако, в конечном счёте, превращается в теплоту. Например, энергия, используемая мышечными клетками, расходуется на преодоление вязкости мышцы и других тканей. Вязкое перемещение вызывает трение, что приводит к образованию тепла.
3. Второе начало термодинамики. Энтропия. Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах. Примеры экзегронических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения.
Второе начало гласит- невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому. Более строго, невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от тела, менее нагретого, к телу, более нагретому.
Понятие
энтропии было впервые введено в 1865 году
Рудольфом Клаузиусом. Он определил
изменение энтропии термодинамической
системы при обратимом процессе как
отношение общего количества тепла ![]() к величине абсолютной температуры
к величине абсолютной температуры
![]() :
:
![]()
Энергия Гиббса
критерий самопроизвольности процессов в открытых и закрытых системах вводится– энергия Гиббса
Энергия Гиббса определяется через энтальпию Н и энтропию S с помощью соотношений:
G = H – S,
ΔG = ΔH – ΔS.
Стр 6
Экзергонический процесс - самопроизвольно протекающий процесс, сопровождающийся уменьшением свободной энергии системы.
Процесс окисления глюкозы дикислородом, сопровождается уменьшением энергии Гиббса и является ярким примером экзергонической реакции в организме человека. Так как он (этот процесс) происходит при физической нагрузке (различной работе совершаемой человеком).
Эндергонический процесс - процесс, протекающий в системе только при поступлении свободной энергии извне.
В живых системах эндергонические процессы сопряжены с экзергоническими. В частности, процессы катаболизма (распад или окисление молекул) обычно являются экзергоническими процессами, а процессы анаболизма - эндергоническими процессами. Таким образом метаболизм есть совокупность взаимодействующих экзергонических и эндергонических процессов. Экзергонические процессы передают свободную энергию для осуществления эндергонических процессов (синтез, активный транспорт, неспецифические эффекты возбуждения, специфические эффекты возбуждения и др.) посредством общего высокоэнергетического соединения. В живых клетках главным таким высокоэнергетическим продуктом является аденозинтрифосфат (АТФ).
В биологической химии важную роль играет принцип энергетического сопряжения, заключающийся в том, что энергия, необходимая для протекания эндергонической реакции, поступает за счет осуществления экзергонической реакции, причем в этих двух реакциях присутствует общее вещество, называемое интермедиатом.
Наиболее распространенной экзергонической реакцией, вступающей в энергетическое сопряжение в условиях организма, является гидролиз АТФ, сопровождающийся переносом остатка фосфорной кислоты на другой субстрат. Например, при образовании сложного эфира глюкозы и фосфорной кислоты одновременно протекают 2 реакции:
АТФ + Н2О → АДФ + Н3РО4; D = -29,2 кДж
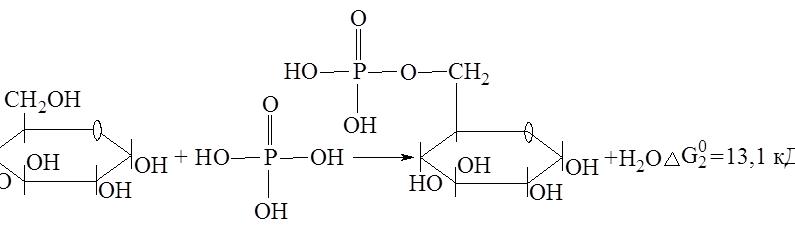
Суммарное уравнение данного процесса можно представить следующим образом:
Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ
Изменение энергии Гиббса будет равно DG0 = –29,2 + 13,1 = –16,1 кДж. Образование глюкозо-6-фосфата из глюкозы возможно, следовательно, только в результате энергетического сопряжения с экзергонической реакцией, сопровождающейся уменьшением энергии Гиббса. Интермедиатом в этой реакции является фосфорная кислота.
4. Зависимость скорости реакции от концентрации. Молекулярность элементарного акта реакции. Порядок реакции. Кинетические уравнения реакций первого и второго порядков. Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Энергия активации.
При
повышении концентрации хотя бы одного
из реагирующих веществ, скорость
химической реакции возрастает в
соответствии с кинетическим
уравнением.
Рассмотрим общее уравнение
реакции: aA
+bB = cC + dD. Для
данной реакции кинетическое уравнение
принимает вид:
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные
реакции —
реакции, в которых происходит химическое
превращение одной молекулы (изомеризация,
диссоциация и т. д.):![]()
Бимолекулярные
реакции —
реакции, элементарный акт которых
осуществляется при столкновении двух
частиц (одинаковых или различных):![]()
Тримолекулярные
реакции —
реакции, элементарный акт которых
осуществляется при столкновении трех
частиц:![]()
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
![]()
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ.
Кинетическое уравнение реакции первого порядка:
![]()
Реакции
второго порядка:
![]()
С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа :

Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
Энергия активации - минимальное количество энергии, которое требуется сообщить системе (дж\моль), чтобы произошла реакция.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
- Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
- Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
- Молекулы должны быть правильно ориентированы относительно друг друга.
5. Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
Катализ - изменение скорости химической реакции при воздействии веществ (катализаторов), которые участвуют в реакции, но не входят в состав продуктов. Катализатор регенерируется после каждого цикла превращения реагентов в продукты.
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1) Диффузия реагирующих веществ к поверхности твердого вещества
2) Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
3) Химическая реакция между реагирующими молекулами
4) Десорбция продуктов с поверхности катализатора
5) Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Энергетический профиль кат.реакции
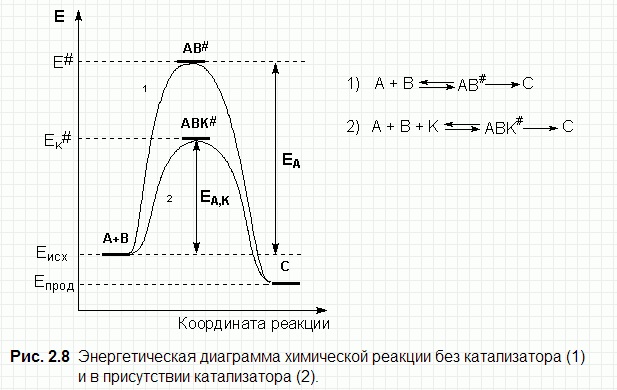
6. Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа химического равновесия. Прогнозирование смещения химического равновесия.
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
А2 + В2 ⇄ 2AB
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации
Факторы, влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении - в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении - в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
1моль=1моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции - в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO₃= 2KCl + 3O₂↑
Константа химического равновесия
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации Сi, парциальные давления Pi или мольные доли Xi реагирующих веществ. Для некоторой реакции
![]()
соответствующие константы равновесия выражаются следующим образом:
 (1)
(1)
 (2)
(2)
 (3)
(3)
7. Классификация растворов: по степени дисперсности, по степени насыщенности. Коллигативные свойства растворов: закон Рауля, понижение температуры замерзания раствора, повышение температуры кипения раствора.
Насыщенность: По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, - ненасыщенным.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Дисперсность: 1) Грубодисперсные - размер частиц - 10⁻⁷ - 10⁻⁵м;
2) Коллоидно-дисперсные - размер частиц- 10⁻⁹ - 10⁻⁷ м;
3) Молекулярно-дисперсные и ионно-дисперсные (истинные растворы) - размер частиц меньше 10⁻⁹ м.
Коллигативные свойства растворов —зависят лишь от количества кинетических единиц и от их теплового движения.
1 Закон Рауля:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль, где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем;
χр-ль — мольная доля растворителя.
2 Закон Рауля: повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора:
ΔTкип/зам= Kкип/зам · mв-ва, где
Kэб/кр —константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе.
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
![]()
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
![]()
