
- •21. Критична точка реального газу
- •22.Фазові перетворення речовини
- •23.Плавлення, випаровування, сублімація і конденсація речовини
- •24.Формула Клапейрона – Клаузіуса
- •25.Потрійна точка речовини
- •26. Процес пароутворення в рідині
- •27. Волога насичена пара
- •28. Діаграма I,s водяної пари*( або „h-s” діаграма )
- •29. Термодинамічні процеси в I,s діаграмі водяної пари
24.Формула Клапейрона – Клаузіуса

Или так


25.Потрійна точка речовини
Візьмемо
речовину у вигляді рідини і яка знаходиться
у рівновазі насиченої пари і , не змінюючи
об’єму, віднімати від неї тепло. Цей
процес буде супроводжуватися зниженням
температури речовини і відповідно
зменшенням тиску. Тому точка, яка зображує
стан речовини на діаграмі (p,T), переміщується
вниз по кривій випаровування. Це
продовжується до тих пір, поки не
досягнеться температура кристалізації
речовини, яка відповідає рівноважному
значенню тиску. Позначимо цю температуру
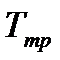 .
Весь час, поки йде процес кристалізації,
температура і тиск залишаються незмінними.
Тепло, що відводиться при цьому,
представляє собою тепло, що виділяються
при кристалізації.
.
Весь час, поки йде процес кристалізації,
температура і тиск залишаються незмінними.
Тепло, що відводиться при цьому,
представляє собою тепло, що виділяються
при кристалізації.
Температура
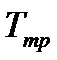 і
відповідний їй рівноважний тиск
і
відповідний їй рівноважний тиск
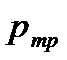 -
єдині значення температури і тиску, при
яких можуть знаходитись в рівновазі
три фази рідини: тверда, рідка і
газоподібна. Відповідна точка на
діаграмі (p,T) називається потрійною
точкою. Таким чином, потрійна точка
визначає умови, за яких можуть знаходитись
в рівновазі одночасно три фази речовини.
-
єдині значення температури і тиску, при
яких можуть знаходитись в рівновазі
три фази рідини: тверда, рідка і
газоподібна. Відповідна точка на
діаграмі (p,T) називається потрійною
точкою. Таким чином, потрійна точка
визначає умови, за яких можуть знаходитись
в рівновазі одночасно три фази речовини.
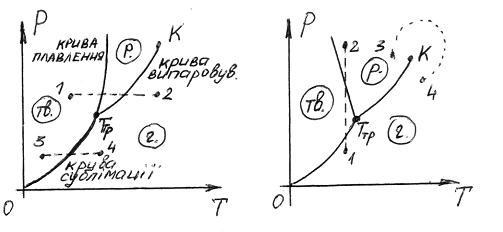
Рис 4
По закінченню процесу кристалізації, в рівновазі будуть тверда і газоподібна фази. Якщо продовжувати забирати тепло від речовини, то температура знову почне знижуватись. Відповідно зменшиться тиск пари, що знаходиться в рівновазі з кристалічною фазою. Точка, що зображує стан речовини, переміщується вниз по кривій сублімації.
Температура потрійної точки є температура, при якій плавиться речовина, знаходячись під писком, що дорівнює . При інших тисках температура плавлення буде іншою. Зв’язок між тиском і температурою плавлення зобразиться кривою плавлення, що починається в потрійній точці.
Криві плавлення, випаровування і сублімації розбивають координатну площину на три області. Зліва від кривих плавлення і сублімації – область твердої фази, між кривими плавлення і випаровування – область рідких станів, справа від кривих сублімації і випаровування – область газоподібних станів речовини.
26. Процес пароутворення в рідині
Пароутворення - це перехід речовини з рідкого стану в газоподібний.
Є два види пароутворення:
а) випаровування;
б) кипіння.
Отже, під час пароутворення внутрішня енергія речовини неодмінно має збільшитись. Це безпосередньо означає, що для здійснення пароутворення необхідно надавати тепло рідині, яка перетворюється у пару. Однак, завдяки особливостям механізму пароутворення та на відміну від плавлення, пароутворення може відбуватись із самочинним поглинанням тепла із оточуючого середовища.
Випаровування - це пароутворення на поверхні рідини. - Випаровування відбувається за будь-якої температури та у будь-яких рідин, що мають вільну поверхню. - Випаровування завжди супроводжується охолодженням рідини. - Інтенсивність випаровування суттєво залежить від кількох зовнішніх чинників (дивіться наступний розділ конспекту).
Кипіння - це пароутворення в об'ємі рідини. - Кипіння відбувається лише за певної для даної рідини та даних умов температури. - Під час кипіння рідини її температура не змінюється. - Температура кипіння суттєво залежить від зовнішнього тиску
Яким же чином відбувається випаровування з поверхні рідини? Молекули рідини рухаються хаотично. Потенціальна енергія їх взаємодії між собою співрозмірна з кінетичною енергією теплового руху. Проте є окремі молекули, швидкості руху яких більші або менші від середнього значення. Молекули з більшими швидкостями, які опиняються біля поверхні рідини, можуть долати притягання сусідніх молекул і залишити рідину. Оскільки загальна кількість молекул рідини є великою, то значною буде і кількість молекул, які залишають її поверхню.
Молекули, які вилетіли з поверхні рідини, утворюють над нею пару.
Молекули, які залишають поверхню рідини, продовжують рухатися хаотично. Частина з них, що знаходяться>найближче до рідини, можуть>захоплюватися>нею. Тобто, між рідиною та парою відбувається двосторонній обмін.
Молекули пари над поверхнею рідини у відкритій посудині поступово розсіюються і в рідину їх повертається порівняно мала кількість. Тому з часом маса рідини, яка переходить у пару, постійно збільшується. Якщо блюдце з водою залишити на деякий час у кімнаті, вода повністю випарується. Чим вищою буде температура рідини, тим більше буде “швидких” молекул, які залишатимуть її поверхню.
Кипіння — це процес пароутворення, що відбувається в усьому об’ємі і поверхні рідини за певної температури.
На відміну від випаровування, яке може відбуватися при будь-якій температурі, кипіння протікає при сталій для кожної рідини температурі. Так ефір кипить при температурі 34,6°С, етиловий спирт при 78,4°С, вода при 100°С, а олія – при температурі 300°С.
Температура, при якій відбувається кипіння, називається температурою кипіння.
Якщо кип’ятити воду в горах, то виявиться, що вона кипітиме при температурі, меншій, ніж 100°С. Чим це можна пояснити? При переході з рідини у пару швидкі молекули води мають виконати роботу з подолання сил взаємного притягання та роботу проти зовнішнього тиску газів та пари. Ці складові роботи виходу молекул з рідини виконуються за рахунок зменшення кінетичної енергії теплового руху — температура рідини знижується. У горах на висоті атмосферний тиск менший, тому робота виходу молекул з рідини зменшується і більша їх кількість може залишити рідину. Кипіння розпочнеться за меншої температури. Із збільшенням температури зростає робота виходу молекул з рідини і кипіння можливе при вищій температурі.
При зменшенні зовнішнього тиску температура кипіння знижується, а при його збільшенні — підвищується.
