
- •21. Критична точка реального газу
- •22.Фазові перетворення речовини
- •23.Плавлення, випаровування, сублімація і конденсація речовини
- •24.Формула Клапейрона – Клаузіуса
- •25.Потрійна точка речовини
- •26. Процес пароутворення в рідині
- •27. Волога насичена пара
- •28. Діаграма I,s водяної пари*( або „h-s” діаграма )
- •29. Термодинамічні процеси в I,s діаграмі водяної пари
21. Критична точка реального газу
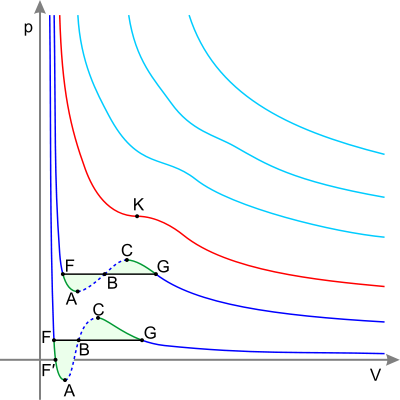
Ізотерми реального газу (схематично) Сині - ізотерми при температурі нижче критичної. Зелені ділянки на них - метастабільні стану. Ділянка лівіше точки F - нормальна рідина. Точка F - точка кипіння. Пряма FG - рівновага рідкої і газоподібної фази. Ділянка FA - перегріта рідина. Ділянка F'A - розтягнута рідина (p <0). Ділянка AC - аналітичне продовження ізотерми, фізично неможливий. Ділянка CG - переохолоджений пар. Точка G - точка роси. Ділянка правіше точки G - нормальний газ. Площі фігури FAB і GCB рівні. Червона - критична ізотерма. K - критична точка.
Також існує таке поняття як критична температура, якщо газ знаходиться при температурі вище критичної (індивідуальна для кожного газу, наприклад для вуглекислого газу приблизно 304 До), то його вже неможливо перетворити в рідину, який би тиск до нього не додавалося. Дане явище виникає внаслідок того, що при критичній температурі сили поверхневого натягу рідини дорівнюють нулю. Якщо продовжувати повільно стискати газ при температурі більшої критичної, то після досягнення нею обсягу, рівного приблизно чотирьом власним обсягами молекул, що складають газ, стисливість газу починає різко падати.
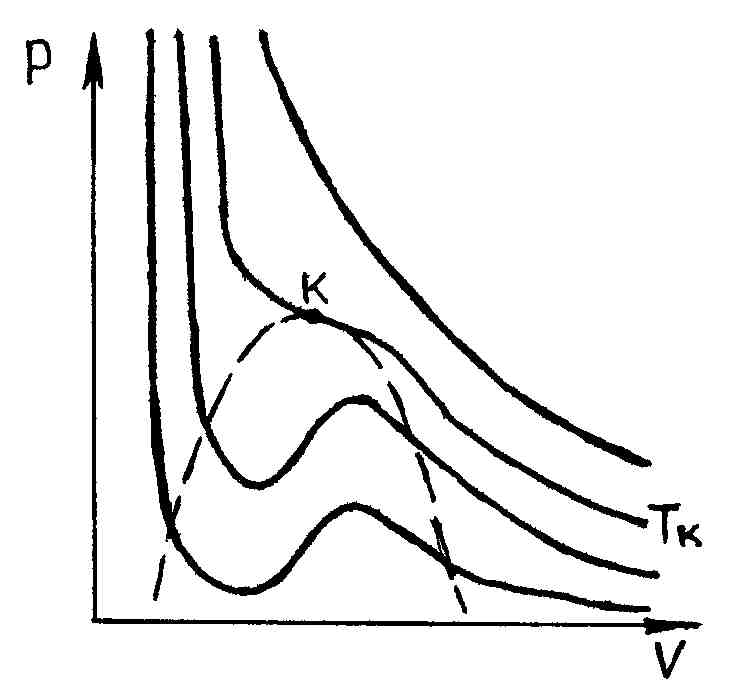
При дуже
високих температурах вони мають форму,
близьку до гіпербол; ці ізотерми
характеризують газоподібний стан
речовини (майже ідеальний газ). У міру
зменшення температури форма ізотерми
змінюється і при деякій температурі
(критична) виявляє точку перегину кривої.
При ще менших температурах (докритичних)
ізотерми замість горизонтальної ділянки,
відповідного фазового переходу рідина
- пара, мають хвилеподібний ділянку
(рис. 53).
 Р
и с. 52 Р и с. 53
Вимірювання показують,
що ізотерми реального речовини практично
збігаються з ізотермою Ван-дер-Ваальса
на дільницях (газоподібний стан) і
(рідкий стан). Однак у середній частині
замість горизонтальної ділянки 51,
відповідного фазового переходу рідина
- пара, ізотерма Ван-дер-Ваальса має
хвилеподібний ділянку. Цей хвилеподібний
ділянку характеризується наступним
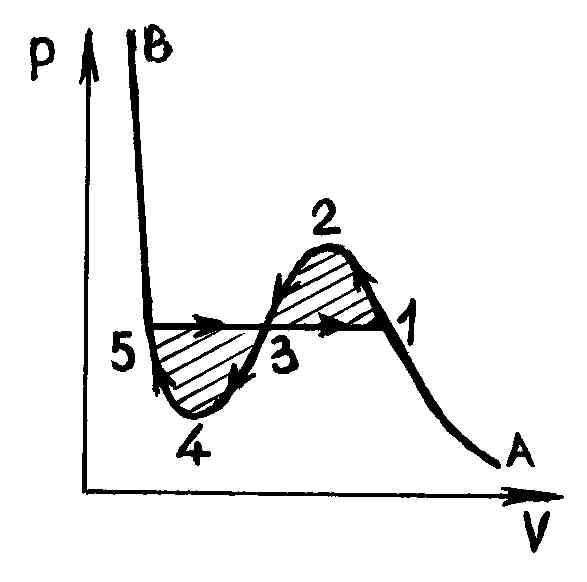
чином. Ділянка 12 відповідає метастабильному
стану пара (пересичений пар), а ділянка
54 - метастабильному стану рідини
(перегріта рідина). У точці 1 є тільки
насичений пар, а в точці 5 - тільки кипляча
рідина. Що стосується ділянки 234
хвилеподібною кривої, то він фізично
неможливий, тому що в природі немає
речовин, для яких при постійній температурі
збільшення обсягу призводило б до
зростання тиску. Останнє можливе лише
в разі, якщо на цій ділянці температура
не є постійною. Пересичений пар (ділянка
12) - газоподібний стан речовини, в якому
тиск p більше, ніж тиск насиченої пари
при даній температурі - можна на досвіді
отримати, стискаючи чистий газ до тиску,
більшого тиску насичених парів, і він
не буде конденсуватися. Стан пересичені
пара, хоча і володіє певною стійкістю,
але воно менш стійко, ніж двофазне стан
(ізобара 135), при якому, як ми знаємо,
частина речовини знаходиться у вигляді
рідини, а частина - у вигляді насиченої
пари. Тому при невеликому зовнішньому
впливі пересичений пар частково
переходить в рідину, а залишився пар
стає насиченим.
Р
и с. 52 Р и с. 53
Вимірювання показують,
що ізотерми реального речовини практично
збігаються з ізотермою Ван-дер-Ваальса
на дільницях (газоподібний стан) і
(рідкий стан). Однак у середній частині
замість горизонтальної ділянки 51,
відповідного фазового переходу рідина
- пара, ізотерма Ван-дер-Ваальса має
хвилеподібний ділянку. Цей хвилеподібний
ділянку характеризується наступним
чином. Ділянка 12 відповідає метастабильному
стану пара (пересичений пар), а ділянка
54 - метастабильному стану рідини
(перегріта рідина). У точці 1 є тільки
насичений пар, а в точці 5 - тільки кипляча
рідина. Що стосується ділянки 234
хвилеподібною кривої, то він фізично
неможливий, тому що в природі немає
речовин, для яких при постійній температурі
збільшення обсягу призводило б до
зростання тиску. Останнє можливе лише
в разі, якщо на цій ділянці температура
не є постійною. Пересичений пар (ділянка
12) - газоподібний стан речовини, в якому
тиск p більше, ніж тиск насиченої пари
при даній температурі - можна на досвіді
отримати, стискаючи чистий газ до тиску,
більшого тиску насичених парів, і він
не буде конденсуватися. Стан пересичені
пара, хоча і володіє певною стійкістю,
але воно менш стійко, ніж двофазне стан
(ізобара 135), при якому, як ми знаємо,
частина речовини знаходиться у вигляді
рідини, а частина - у вигляді насиченої
пари. Тому при невеликому зовнішньому
впливі пересичений пар частково
переходить в рідину, а залишився пар
стає насиченим.
Як
було вже зазначено,
в
критичній
точці
ізотерма
![]() має
дотичну
і
перегин.
має
дотичну
і
перегин.
