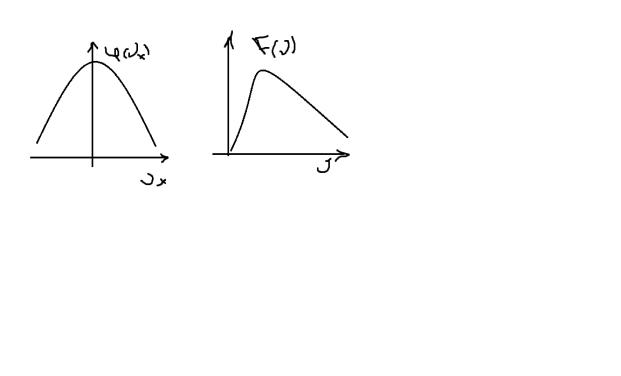- •2. Характеристики движения материальной точки.
- •3. Движение точки по окружности
- •5. Виды сил в механике.
- •14.Законы сохранения в механике.
- •17.Силы инерции.
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 41: Тепловые скорости молекул.
- •Вопрос 42: Барометрическая формула. Распределение Больцмана.
- •Вопрос 43: Первый закон термодинамики.
- •Вопрос 44: Теплоемкость
- •Вопрос 46: Обратимые и необратимые процессы.
- •Вопрос 47: Энтропия
- •Вопрос 48: Циклические процессы. Теорема Карно.
- •Вопрос 49: Второй закон термодинамики.
- •Вопрос 50: Третий закон термодинамики.
- •Вопрос 57.Смачивание.Капиллярные явления.
- •Вопрос 58.Неравновесные процессы.
- •59. Основные уравнения явлений переноса.
- •60. Кинетические коэффициенты
Вопрос 36
Термодинамической системой наз-ся совокупность микроскопических объектов, обменивающихся энергией в форме работы и теплоты как друг с другом , так и с внешней средой. Терм-я система наз-ся замкнутой или изолированной, если она не может обмениваться с внешней средой ни энергией, ни веществом. Терм-я система наз-ся изолированной в тепловом отношении или адиабатной, если отсутствует теплообмен между ней и окружающей средой. Терм-я система наз-ся изолированной в механическом отношении , если она способна обмениваться с внешней средой энергией только путём теплообмена, без совершения механической работы. Терм-я система наз-ся открытой, если она обменивается с внешней средой и веществом и энергией. Терм-я система наз-ся закрытой, если она обменивается веществом с внешней средой. Гомогенной наз-ся Терм-я система, внутри которой нет поверхности раздела, отделяющих друг от друга макроскопические части системы. В противном случае она наз-ся гетерогенной. Фазой наз-ся гомогенная часть гетерогенной системы. Термодин-ми параметрами (параметрами состояния) наз-ся физ-е величины, характеризующие состояние термодинамической ситемы. Термодин-е параметры, значения которых пропорц-ны кол-ву вещ-ва, наз-т экстенсивными(масса, объём) ; значения же которых не зависят от кол-ва вещ-ва – интенсивными(температура, намагниченность).Внешними параметрами системы наз-ся физические величины, зависящие от положения и свойств тел, которые явл-ся внешними по отношению к данной системе.(например, для газа –объём). Внутренними параметрами системы наз-ся физ-е величины, зависящие как от положения внешних тел, так и от состояния движения частиц , образующих систему. Равновесными наз-ся состояния термодин-й системы , характеризующееся при неизменных внешних условиях постоянных параметров системы и отсутствием в в системе различных потоков. Термодин-м процессом наз-ся всякое изменение состояний термодин-й системы , при котором изменяется хотябы один её параметр. Термодинам-й процесс наз-ся равновесным, если система проходит непрерывный ряд термодинм-ки равновесных состояний.
Вопрос 37
В молекулярной
физике используют модель идеального
газа, в которой считают, что молекулы
большую часть времени нах-ся в состоянии
свободного движения, при этом их
потенциальная энергия равна нулю, а
полная энергия газа равна сумме
кинетических энергий молекул.Уравнение
связывающие между собой давление газа,
его объём и температуру, наз-ся термическим
ур-ем состояния: ![]() .
Таким ур-ем описывается состояние
простой ситемы, у которой имеется один
внешний параметр V,
а внешних полей нет. Для идеального газа
используется ур-е состояния:
.
Таким ур-ем описывается состояние
простой ситемы, у которой имеется один
внешний параметр V,
а внешних полей нет. Для идеального газа
используется ур-е состояния: ![]() или
или ![]() Из ур-я
можно получить ур-я некоторых процессов,
пологая равной константе давление,
температуру, объём. Эти процессы наз-ся
соот-но изобарный, изохорный, изотермический.
Для идеального газа справедлив закон
Дальтона: давление смеси газов равно
сумме парциальных давлений каждого
газа.
Из ур-я
можно получить ур-я некоторых процессов,
пологая равной константе давление,
температуру, объём. Эти процессы наз-ся
соот-но изобарный, изохорный, изотермический.
Для идеального газа справедлив закон
Дальтона: давление смеси газов равно
сумме парциальных давлений каждого
газа. ![]() Вопрос
38
Вопрос
38
Найдём давление,
оказываемое молекулами идеального газа
на стенку сосуда, в котором он находится.
Считаем удары молекул абсолютно упругими,
т.е. угол падения Θ равен углу отражения
от стенки.Импульс, сообщаемый одной
молекуле массы m
, движущейся к стенке со скоростью v,
равен: 2mvcosΘ.
Столкнулся со стенкой площади ΔS
за время Δt
молекулы, нах-ся от стенки по направлению
движения по направлению движению на
расстоянии vΔt.
Число таких молекул, движущихся в
пределах телесного угла ![]() ,
равно их числу, попавшему в объём косого
цилиндра
,
равно их числу, попавшему в объём косого
цилиндра ![]() :
:
![]() , где вт(м)- число молекул в единице
объёма, имеющих скорость в пределах от
v
до v+dv.
Импульс, переданный стенке всеми такими
молекулами:
, где вт(м)- число молекул в единице
объёма, имеющих скорость в пределах от
v
до v+dv.
Импульс, переданный стенке всеми такими
молекулами: ![]() . Интегрируя в сферической системе
координат это выражение по направлениям
полупространства
. Интегрируя в сферической системе
координат это выражение по направлениям
полупространства ![]() ,
,
![]() ,
имеем:
,
имеем: ![]() .
Давление, с учётом второго закона
Ньютона, записанного в импульсной форме,
определяется соотношением:
.
Давление, с учётом второго закона
Ньютона, записанного в импульсной форме,
определяется соотношением: ![]() .
Введём понятие средней квадратичной
скорости как:
.
Введём понятие средней квадратичной
скорости как: ![]() .
Значения интегралов (1) по
.
Значения интегралов (1) по ![]() соответственно равный 1/3 и 2π. С учётом
всего сказанного:
соответственно равный 1/3 и 2π. С учётом
всего сказанного: ![]() .
Если ввести среднюю кинетическую энергию
молекул
.
Если ввести среднюю кинетическую энергию
молекул ![]() ,
то (2) примет вид:
,
то (2) примет вид: ![]()
Вопрос 39.Средняя
энергия молекул![]() .
Термодинамическая температура есть
величена пропорциональный средней
энергии поступательного движения
молекл. По причине изотропности св-в
газа (одинаковости св-в в разных
направлениях)
.
Термодинамическая температура есть
величена пропорциональный средней
энергии поступательного движения
молекл. По причине изотропности св-в
газа (одинаковости св-в в разных
направлениях) ![]() ,
где
,
где ![]() обазначено среднее значение квадрата
одной компоненты скорости:
обазначено среднее значение квадрата
одной компоненты скорости: ![]() .
Числом степеней свободы механической
системы наз-ся число независимых
параметров, полностью определяющих
положение системы в пространстве.(для
одноатомной молекулы число степенй
свободы равно i=3)
На каждую степень свободы молекулы
приходится в среднем одинаковая
кинетическая энергия равная kT/2.
На всю молекулу, таким образом, приходится
энергия ikT/2,
а на моль идеального газа:
.
Числом степеней свободы механической
системы наз-ся число независимых
параметров, полностью определяющих
положение системы в пространстве.(для
одноатомной молекулы число степенй
свободы равно i=3)
На каждую степень свободы молекулы
приходится в среднем одинаковая
кинетическая энергия равная kT/2.
На всю молекулу, таким образом, приходится
энергия ikT/2,
а на моль идеального газа: ![]()
Вопрос 40
![]() (1),
(1),
![]() (2)
Выражений (1)и(2) представляют распределение
молекул газа по скоростям, принадлежащие
Максвелу. При увеличении температуры
максимум кривой F(v)
смещается в сторону больших v,
так что площадь под кривой остаётся при
любой температуре равной 1.
(2)
Выражений (1)и(2) представляют распределение
молекул газа по скоростям, принадлежащие
Максвелу. При увеличении температуры
максимум кривой F(v)
смещается в сторону больших v,
так что площадь под кривой остаётся при
любой температуре равной 1.