
- •2. Характеристики движения материальной точки.
- •3. Движение точки по окружности
- •5. Виды сил в механике.
- •14.Законы сохранения в механике.
- •17.Силы инерции.
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 41: Тепловые скорости молекул.
- •Вопрос 42: Барометрическая формула. Распределение Больцмана.
- •Вопрос 43: Первый закон термодинамики.
- •Вопрос 44: Теплоемкость
- •Вопрос 46: Обратимые и необратимые процессы.
- •Вопрос 47: Энтропия
- •Вопрос 48: Циклические процессы. Теорема Карно.
- •Вопрос 49: Второй закон термодинамики.
- •Вопрос 50: Третий закон термодинамики.
- •Вопрос 57.Смачивание.Капиллярные явления.
- •Вопрос 58.Неравновесные процессы.
- •59. Основные уравнения явлений переноса.
- •60. Кинетические коэффициенты
Вопрос 50: Третий закон термодинамики.
В любых обратимых изотермических процессах, совершаемых между двумя равновесными состояниями при температурах, приближающихся к абсолютному нулю, изменение энтропии S стремится к нулю:
-
lim S 0 .
(2.83)
T 0
Эта теорема, установленная Нернстом, называется третьим законом термо-динамики.
В формулировке Планка он записывается так. При стремлении термо-
динамической температуры тел к нулю их энтропия обращается в нуль. Это позволяет константу в (2.72) при интегрировании по температуре от 0 до T считать равной нулю. При T 0 теплоемкости CP и CV , коэффициент объ-
емного расширения V T также стремятся к нулю. Из теоремы Нернста
следует, что невозможен такой термодинамический процесс, который приво-дил бы к охлаждению системы до температуры T 0 .
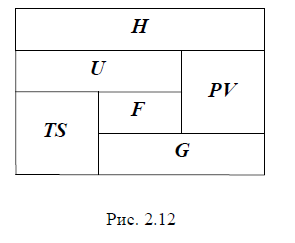
10.10 Термодинамические потенциалы.
|
|
|
|
|
|
||
известно аналитическое выражение любо- |
|
|
|
|
|
|
|
|
|
H |
|
|
|||
го термодинамического потенциала через |
|
|
|
|
|||
|
|
|
|
|
|||
независимые параметры системы, то мож- |
|
|
|
|
|||
но в явной форме определить все ее тер- |
|
|
|
|
|||
|
|
||||||
модинамические величины. Все термоди- |
TS |
|
|
|
|||
намические потенциалы аддитивны, кро- |
|
|
|
|
|||
G |
|
|
|||||
|
|
|
|||||
ме того, их дифференциалы являются |
|
|
|
||||
|
|
|
|
|
|||
полными, значит, термодинамические по- |
|
|
|
|
|
||
тенциалы сами являются функциями со- |
|
Рис. 2.12 |
|
||||
стояния системы. В простых системах ис- |
|
|
|
|
|
||
пользуют следующие термодинамические потенциалы: |
|
||||||
внутренняя энергия U; |
|
|
|
|
|
||
свободная энергия (энергия Гельмгольца) |
|
|
|
|
|
||
F U TS ; |
(2.84) |
|
|||||
энтальпия (тепловая функция) |
|
|
|
|
|
||
H U PV ; |
(2.85) |
|
|||||
энергия Гиббса (потенциал Гиббса) |
|
|
|
|
|
||
G U PV TS ; |
(2.86) |
|
|||||

Соотношение между ними удобно представить в графическом виде (рис. 2.12).
1. Для дифференциала внутренней энергии в обратимых процессах справедливо соотношение, полученное из (2.82):
-
dU TdS pdV ,
(2.87)
из чего следует, что независимыми переменными для U являются S и V.
В изохорном процессе dU QV .
В адиабатическом процессе dU AS .
-
U
U
● T
, p
.
S V
V S
2. Для дифференциала свободной энергии с учетом (2.87) справедливо
соотношение
-
dF SdT pdV ,
(2.88)
из чего следует, что независимыми переменными для F являются T и V. ● В изотермическом процессе dF AT .
-
F
F
● S
; p
.
T V
V T
● В необратимом процессе при постоянных T и V, разделив (2.82) на изменение времени dt и перегруппировав слагаемые, получим:
dU TS dF 0 . dt dt
В таком процессе свободная энергия уменьшается и достигает минимума в состоянии равновесия.
3. Для дифференциала энтальпии с учетом (2.87) справедливо соот-ношение:
-
dH TdS Vdp ,
(2.89)
из чего следует, что независимыми переменными для H являются S и p.: ● В изобарном процессе dH QP .
-
H
H
● T
; V
.
S P
pS
4. Для дифференциала энергии Гиббса с учетом (2.87) справедливо соотношение:
-
dG Vdp SdT ,
(2.90)
из чего следует, что независимыми переменными для G являются p и T.
-
G
G
● V
; S
.
T P
pT
● В необратимом процессе при постоянных p и T аналогично получа-
ем:
dU PV TS dG 0 . dt dt
В таком процессе энергия Гиббса уменьшается и достигает минимума в со-стоянии равновесия.
51. Термодинамические потенциалы. Широкое распространение в термодинамике получил метод исследования, развитый Гиббсом. Он основан на использовании так называемых термодинамических потенциалов – таких функций независимых макроскопических термодинамических параметров, которые полностью задают термодинамическое состояние системы. Если известно аналитическое выражение любого термодинамического потенциала через
независимые
параметры системы, то можно в явной
форме определить все ее термодинамические
величины. Все термодинамические
потенциалы аддитивны, кроме того, их
дифференциалы являются полными, значит,
термодинамические потенциалы сами
являются функциями состояния системы.
В простых системах используют следующие
термодинамические потенциалы: внутренняя
энергия U; свободная энергия (энергия
Гельмгольца):
F=U-TS(1),
энтальпия
(тепловая функция)H
=U + PV (2); энергия
Гиббса
(потенциал Гиббса)G =U + PV - TS (3). ). 1.
Для дифференциала внутренней энергии
в обратимых процессах справедливо
соотношение, dU = TdS – pdV, из чего следует,
что независимыми переменными для U
являются S.● В изохорном процессе dU=![]() .
● В адиабатическом
процессе dU=-
.
● В адиабатическом
процессе dU=-![]() .
●T=
.
●T=![]() V,
p=
V,
p=![]() S.
2.
Для дифференциала свободной энергии
справедливо соотношениеdF
= -SdT
- pdV,из
чего следует,что для независимыми
переменными для F
явл-ся для T
и V.
● В изотермическом
процессе
S.
2.
Для дифференциала свободной энергии
справедливо соотношениеdF
= -SdT
- pdV,из
чего следует,что для независимыми
переменными для F
явл-ся для T
и V.
● В изотермическом
процессе ![]() ●S=-(
●S=-(![]() )V;p=-(
)V;p=-(![]() )T.
● В необратимом
процессе при постоянных T и V получим:
)T.
● В необратимом
процессе при постоянных T и V получим:![]() .
В таком процессе
свободная энергия уменьшается и достигает
минимума в cостоянии
равновесия. 3.
Для дифференциала энтальпии с учетом
справедливо соотношение: dH = TdS + Vdp ,из
чего следует, что независимыми переменными
для H являются S и p.:
● В изобарном
процессе:dH=
.
В таком процессе
свободная энергия уменьшается и достигает
минимума в cостоянии
равновесия. 3.
Для дифференциала энтальпии с учетом
справедливо соотношение: dH = TdS + Vdp ,из
чего следует, что независимыми переменными
для H являются S и p.:
● В изобарном
процессе:dH=![]() .
●T=(
.
●T=(![]() )p;V=(
)p;V=(![]() )S.
4. Для
дифференциала энергии Гиббса с учетом
справедливо соотношение: dG
=Vdp
- SdT
, из чего следует, что независимыми
переменными для G
являются p
и T.
●V=(
)S.
4. Для
дифференциала энергии Гиббса с учетом
справедливо соотношение: dG
=Vdp
- SdT
, из чего следует, что независимыми
переменными для G
являются p
и T.
●V=(![]() )r;S=-(
)r;S=-(![]() )p.
● В необратимом
процессе при постоянных p и T аналогично
получаем:
)p.
● В необратимом
процессе при постоянных p и T аналогично
получаем:
d(U+pV-TS)/dt=dG/dt≤0. В таком процессе энергия Гиббса уменьшается и достигает минимума в состоянии равновесия.
52.Межмолекулярное
взаимодействие. Уравнение состояния
реальных газов. Молекулы
в реальном газе взаимодействуют между
собой. Это взаимодействие начинает
проявляться на расстоянии порядка 10^-9
м в виде притяжения. На расстоянии
порядка 10^-10 м притяжение сменяется
взаимным отталкиваем. Сила притяжения
и отталкивания зависят от расстояния
между ними по степенному закону F![]() ,
где n
,
где n ![]() 13
для отталкивания и n
7
для притяжения. Газообразному состоянию
соответствует соотношение kT >W0
, жидкому kT ≤W0
, твердому
13
для отталкивания и n
7
для притяжения. Газообразному состоянию
соответствует соотношение kT >W0
, жидкому kT ≤W0
, твердому
kT <W0 . Идеальный газ является моделью, которая хорошо описывает состояние газа в пределе высоких температур и низких давлений. В остальных случаях имеются более или менее значительные отклонения. Во многих случаях уравнение состояния идеального газа Менделеева-Клапейрона является непригодным. Для описания реальных газов были предложены соответствующие уравнения состояния.
Уравнение состояния Ван-дер-Ваальса для одного моля газа имеет вид:
(p+![]() )(Vm-b)=RT
(1)Ван-дер-Ваальс
)(Vm-b)=RT
(1)Ван-дер-Ваальс
где р – давление, Vm– молярный объем, Т – термодинамическая температура.
Константа b определяет суммарный объем, занятый всеми молекулами газа вследствие конечности их размеров, а поправка a/V2– некоторое «внутреннее» давление, обусловленное взаимным притяжением молекул. Для ν молей уравнение (1) имеет вид:
(p+![]() )(
)(![]() – b)=RT
– b)=RT
Более точными уравнениями состояния реальных газов являются:
● Первое и второе уравнения Дитеречи:
P(Vm-b)=Rt
exp(-![]() )(1):
(p+
)(1):
(p+![]() )(Vm-b)=RT(2)
(1) и (2)-ур-е Дитеречи.
)(Vm-b)=RT(2)
(1) и (2)-ур-е Дитеречи.
● Ур-е
Бертло (p+![]() )(Vm-b)=RT
)(Vm-b)=RT
●Вириальная
форма (1+![]() +
+![]() +
+![]() +
…),где B, C, D – функции температуры,
называющиеся вириальными коэффициентами.
+
…),где B, C, D – функции температуры,
называющиеся вириальными коэффициентами.
55.Фазовый
переход 1-го рода. Фазой называется
термодинамически равновесное состояние
вещества, отличающееся по физическим
свойствам от других возможных равновесных
состояний того же вещества. Если,
например, в закрытом сосуде находится
вода, то эта система является двухфазной: жидкая
фаза — вода; газообразная фаза — смесь
воздуха с водяными парами. Если в воду
бросить кусочки льда, то эта система
станет трехфазной, в которой лед
является твердой фазой. Часто понятие
«фаза» употребляется в смысле агрегатного
состояния, однако надо учитывать, что
оно шире, чем понятие «агрегатное
состояние». В пределах одного агрегатного
состояния вещество может находиться в
нескольких фазах, отличающихся по своим
свойствам, составу и строению (лед,
например, встречается в пяти различных
модификациях — фазах). Переход вещества
из одной фазы в другую — фазовый
переход —
всегда связан с качественными изменениями
свойств вещества. Примером фазового
перехода могут служить изменения
агрегатного состояния вещества или
переходы, связанные с изменениями в
составе, строении и свойствах вещества
(например, переход кристаллического
вещества из одной модификации в другую).
Различают фазовые переходы двух
родов. Фазовый
переход I рода (например,
плавление, кристаллизация и т. д.)
сопровождается поглощением или выделением
теплоты, называемой теплотой
фазового перехода.
Фазовые переходы I рода характеризуются
постоянством температуры, изменениями
энтропии и объема. Объяснение этому
можно дать следующим образом. Например,
при плавлении телу нужно сообщить
некоторое количество теплоты, чтобы
вызвать разрушение кристаллической
решетки. Подводимая при плавлении
теплота идет не на нагрев тела, а на
разрыв межатомных связей, поэтому
плавление протекает при постоянной
температуре. В подобных переходах — из
более упорядоченного кристаллического
состояния в менее упорядоченное жидкое
состояние — степень беспорядка
увеличивается, т. е., согласно второму
началу термодинамики, этот процесс
связан с возрастанием энтропии системы.
Если переход происходит в обратном
направлении (кристаллизация), то система
теплоту выделяет. ![]() =
=![]() -уравнение
Клайперона-Клаузиуса.
-уравнение
Клайперона-Клаузиуса.
56.Фазовый
переход 2-го рода. Фазой называется
термодинамически равновесное состояние
вещества, отличающееся по физическим
свойствам от других возможных равновесных
состояний того же вещества. Если,
например, в закрытом сосуде находится
вода, то эта система является двухфазной: жидкая
фаза — вода; газообразная фаза — смесь
воздуха с водяными парами. Если в воду
бросить кусочки льда, то эта система
станет трехфазной, в которой лед
является твердой фазой. Часто понятие
«фаза» употребляется в смысле агрегатного
состояния, однако надо учитывать, что
оно шире, чем понятие «агрегатное
состояние». В пределах одного агрегатного
состояния вещество может находиться в
нескольких фазах, отличающихся по своим
свойствам, составу и строению (лед,
например, встречается в пяти различных
модификациях — фазах). Переход вещества
из одной фазы в другую — фазовый
переход —
всегда связан с качественными изменениями
свойств вещества. Примером фазового
перехода могут служить изменения
агрегатного состояния вещества или
переходы, связанные с изменениями в
составе, строении и свойствах вещества
(например, переход кристаллического
вещества из одной модификации в другую).
Фазовые переходы, не связанные с
поглощением или выделением теплоты и
изменением объема, называются фазовыми
переходами II рода.
Эти переходы характеризуются
постоянством объема и энтропии, но
скачкообразным изменением теплоемкости.
Общая трактовка фазовых переходов II
рода предложена академиком Л. Д. Ландау
(1908—1968). Согласно этой трактовке, фазовые
переходы II рода связаны с изменением
симметрии: выше точки перехода система,
как правило, обладает более высокой
симметрией, чем ниже точки перехода.
Примерами фазовых переходов II рода
являются: переход ферромагнитных
веществ (железа, никеля) при определенных
давлении в температуре в парамагнитное
состояние; переход металлов и некоторых
сплавов при температуре, близкой к 0 К,
в сверхпроводящее состояние, характеризуемое
скачкообразным уменьшением
электрического сопротивления до нуля;
превращение обыкновенного жидкого
гелия (гелия I) при Т=2,9
К в другую жидкую модификацию (гелий
II), обладающую свойствами сверхтекучести.
ΔCp=
- T(![]() )^2*Δ(
)^2*Δ(![]() )T;
Δ(
)T;
Δ(![]() )p=
-
*Δ(
)p=
-
*Δ(![]() )Tуравнение
Эренфеста.
)Tуравнение
Эренфеста.

 Широкое
распространение в термодинамике
получил метод исследова-ния,
развитый Гиббсом.
Он основан на использовании так
называемых тер-модинамических
потенциалов –
таких функций независимых
макроскопиче-ских
термодинамических параметров,
которые полностью задают термодинамическое
состояние системы.
Если
Широкое
распространение в термодинамике
получил метод исследова-ния,
развитый Гиббсом.
Он основан на использовании так
называемых тер-модинамических
потенциалов –
таких функций независимых
макроскопиче-ских
термодинамических параметров,
которые полностью задают термодинамическое
состояние системы.
Если