
- •2. Характеристики движения материальной точки.
- •3. Движение точки по окружности
- •5. Виды сил в механике.
- •14.Законы сохранения в механике.
- •17.Силы инерции.
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 41: Тепловые скорости молекул.
- •Вопрос 42: Барометрическая формула. Распределение Больцмана.
- •Вопрос 43: Первый закон термодинамики.
- •Вопрос 44: Теплоемкость
- •Вопрос 46: Обратимые и необратимые процессы.
- •Вопрос 47: Энтропия
- •Вопрос 48: Циклические процессы. Теорема Карно.
- •Вопрос 49: Второй закон термодинамики.
- •Вопрос 50: Третий закон термодинамики.
- •Вопрос 57.Смачивание.Капиллярные явления.
- •Вопрос 58.Неравновесные процессы.
- •59. Основные уравнения явлений переноса.
- •60. Кинетические коэффициенты
Вопрос 44: Теплоемкость
Теплоемкостью тела называется величина, равная количеству тепло-ты, которое нужно сообщить телу, чтобы повысить его температуру на один Кельвин.
Стела |
|
Q |
. |
(2.49) |
|
|
|
|
|
||||
|
|
dT |
|
|
||
Удельной теплоемкостью называется теплоемкость единицы массы вещества |
|
|||||
|
|
|
|
|
|
|
c |
Q |
. |
(2.50) |
|
||
|
|
|||||
|
mdT |
|
|
|||
Молярной теплоемкостью называется теплоемкость одного моля вещества
-
С
Q
c
(2.51)
dT
Поскольку Q определяется процессом теплопередачи, теплоемкость
тоже различна для различных процессов. Наиболее важными, получившими наибольшее применение, являются молярные теплоемкости при постоянных объеме и давлении СV и СP (изохорная и изобарная молярные теплоемко-
сти).
В случае изохорного процесса A 0 и Q dU . Тогда
-
C
dU M
,
(2.52)
V
dT
где U M – внутренняя энергия одного моля вещества. Производная по темпе-
ратуре в (2.52) берется при условии постоянства объема, она является част-ной. Такие производные принято записывать в виде:
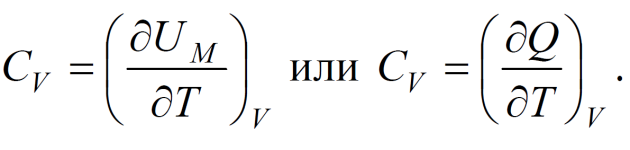
Внутренняя энергия определена с точностью до константы, т. к. в термоди-намике всегда рассматривается изменение этой величины в различных про-цессах. Поэтому из (2.52) или (2.53) следует:
-
U C T ,
m
.
(2.54)
V
Для изобарного процесса |
|
первый закон термодинамики |
|
||||
QP dU pdV . Разделим это уравнение на dT, получим: |
|
||||||
Q |
P |
C |
|
|
|
V |
|
|
P |
C p |
. |
|
|||
dT |
|
V |
|
T P |
|
||
|
|
|
|
||||
имеет вид
(2.55)
Воспользовавшись уравнением |
состояния идеального газа, |
найдем |
|
|
R p , тогда CP CV |
R . После сокращения это уравнение |
|
приобретает вид: |
|
|
|
|
CP CV R |
(2.56) |
|
Его называют уравнением Майера. Подставляя в (2.53) формулу (2.15), учи-тывая (2.56), получим:
-
C
i
R ,
C
P
i 2
R .
(2.57)
V
2
2
Здесь i – число степеней свободы молекулы газа.
Ворпрос 45: Основные изопроцессы в идеальном газе
Изопроцессом называется термодинамический процесс, происходящий с газом при неизменном значении какого-либо его параметра. Рассмотрим изопроцессы в идеальном газе.
1. Изобарный процесс. Уравнение процесса можно получить из урав-нения Менделеева-Клапейрона при p const .
-
V
R
T const T .
(2.58)
p
На диаграмме V, T процесс имеет вид прямой, проходящей через начало ко-ординат. Работа в изобарном процессе:
-
V
A 2
pdV pV2 V1 .
(2.59)
V1
2. Изохорный процесс. Аналогично получаем уравнение процесса при
V const :
-
P
R
T const T .
(2.60)
V
На диаграмме p, T процесс имеет вид прямой, проходящей через начало ко-ординат. При неизменном объеме работа газа равна нулю.
3. Изотермический процесс. Уравнение процесса при Т const имеет
вид:
-
pV RT const .
(2.61)
На диаграмме p,V изотермический процесс изображается гиперболой p~ V1 .
Найдем работу газа в этом процессе:
-
V2
V2 dV
V2
A pdV RT
RT ln
.
(2.62)
V
V
V
V
1
1
1
4. Адиабатический процесс. Такой процесс характеризуется отсутст-вием теплообмена с внешней средой. В течение процесса постоянной остает-ся энтропия S. Найдем уравнение процесса. Согласно первому закону термо-динамики при Q 0 :
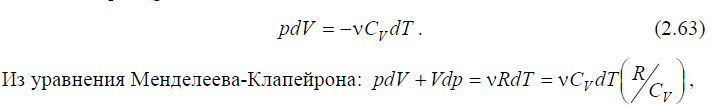
откуда выражаем CV dT и подставляем в (2.63). С учетом (2.56), получаем:
CP pdV CV Vdp 0
Разделяем переменные и интегрируем. Окончательно приходим к уравнению адиабатического процесса:
PV const , (2.64)
![]()
где CP CV 1 – показатель адиабаты. Его можно представить через i –
число степеней свободы молекулы i i 2 1 2i . Работа в адиабатическом процессе равна:
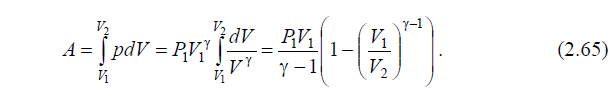
5. Политропический процесс. Этот процесс происходит с газом при постоянной теплоемкости C const . Представим Q CdT , тогда первый
закон термодинамики примет вид CdT CV dT pdV или
C CV dT pdV 0 . |
|
(2.66) |
|
|||||
Из уравнения Менделеева-Клапейрона получаем: |
|
|
|
|||||
|
pdV Vdp RdT . |
|
(2.67) |
|
||||
Умножим (2.66) на |
R |
и |
учтем |
|
(2.67). Тогда |
получаем: |
|
|
C CV pdV Vdp pRdV 0 . |
Раскрывая скобки, деля все |
уравнение на |
|
|||||
PV, получаем: |
|
|
|
|
|
|
|
|
C C |
R |
pdV |
C C |
|
dp |
0 . |
(2.68) |
|
V |
p |
|
||||||
V |
|
V |
|
|
|
|
||
Принимая во внимание уравнение Майера, интегрируем (2.68). Получаем в результате:
-
pV n const ,
(2.69)
где n C CP – показатель политропы.
C CV
Работа в политропическом процессе имеет вид, подобный (2.65):
-
PV
V
n1
A
1 1
1
.
(2.70)
n 1
V2
Следует заметить, что все рассмотренные в п. 1-4 процессы являются частным случаем политропического процесса. В каждом из них теплоемкость и n принимают частные значения, согласно таблице.
-
Таблица 1
Процесс
Изобарный
Изохорный
Изотермический
Адиабатический
n
0
∞
1
γ
C
CP
CV
∞
0
