- •5)Работа расширения и техническая работа
- •6)Первый закон термодинамики
- •Частные случаи первого закона термодинамики для изопроцессов
- •7 ) Второе начало термодинамики .Обратимые и необратимые процессы .Энропия .
- •Обратимые и необратимые процессы
- •Смесь газов. Закон Дальтона.
- •12. Адиабатный процесс
- •13 .Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
- •14. Самым простым и известным уравнением состояния является уравнение состояния идеального газа:
- •15)Термодинамические свойства паров и жидкостей. Фазовые переходы. Расчет параметров влажного пара.
- •16)Термодинамические процессы реальных газов и паров
- •17)Адиабатный процесс расширения и сжатия реальных газов и паров.
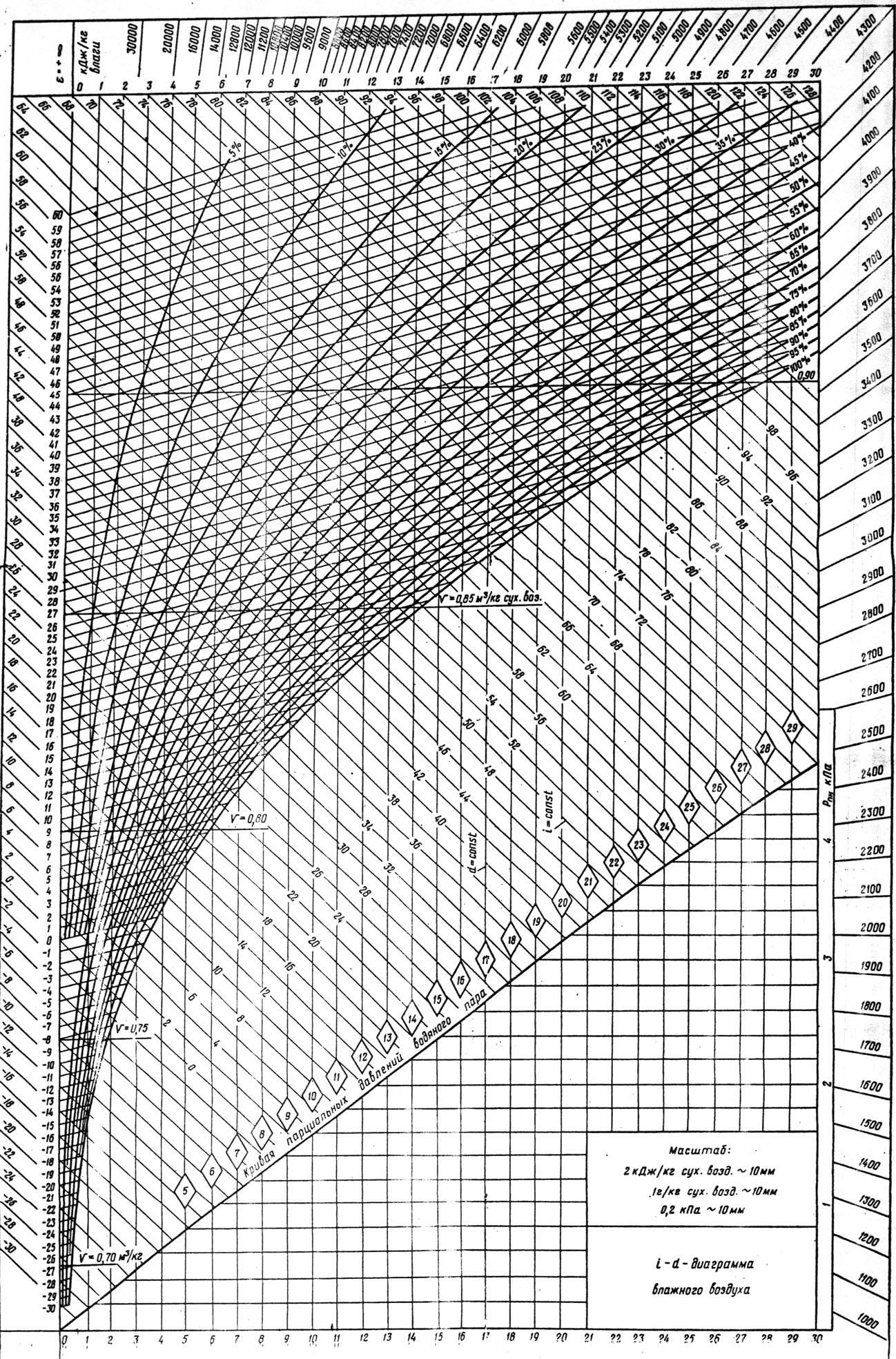
- •18)Влажный воздух. Основные понятия и определения. H-d- диаграмма влажного воздуха.
- •19)Общие уравнения истечения газов и паров. Уравнение сплошности. Сопло и диффузор.
- •20)Истечение идеального газа. Максимальных расход. Сопло Лаваля.
18)Влажный воздух. Основные понятия и определения. H-d- диаграмма влажного воздуха.
Сухим воздухом называется воздух, не содержащий водяных паров. В атмосферном воздухе всегда содержится некоторое количество водяного пара.
Влажным воздухом называется смесь сухого воздуха с водяным паром.
В теплотехнике некоторые газообразные тела принято называть паром. Так, например, вода в газообразном состоянии называется водяным паром, аммиак – аммиачным паром.
Рассмотрим более подробно термодинамические свойства воды и водяного пара. (1-6).
Процесс превращения вещества из жидкого состояния в газообразное называется парообразованием.Образование пара из одноименной жидкости происходит посредством испарения и кипения. Между данными процессами существует принципиальное различие.Испарение жидкости происходит лишь с открытой поверхности. Отдельные молекулы, имеющие большую скорость, преодолевают притяжение соседних молекул и вылетают в окружающее пространство. Интенсивность испарения возрастает с увеличением температуры жидкости.Сущность кипения состоит в том, что генерация пара происходит в основном в объеме самой жидкости за счет испарения ее внутрь пузырьков пара.Переход вещества из газообразного состояния в жидкое называется конденсациейПар какого-либо вещества, находящийся в динамическом равновесии с одноименной жидкостью, называется насыщенным паром.
Различают следующие состояния водяного пара:
влажный пар;
сухой насыщенный пар;
перегретый пар.
Влажный пар – насыщенный пар, содержащий в себе одноименную жидкость в виде взвешенных мелкодисперсных частиц. Сухой насыщенный пар – пар, не содержащий одноименной жидкости и имеющий температуру кипения tH при данном давлении PП.Индекс “н” при температуре обозначает насыщение (или кипение). Перегретый пар – пар, температура которого превышает температуру кипения (tП>tН) при данном давлении Р.
Рассмотрим характер и расположение изобар (процесс при постоянном давлении P=const) воды и водяного пара в Ts-диаграмме. Энтропия S является термодинамическим параметром состояния вещества.
Полагая, что изобары при любом давлении начинаются от температуры тройной точки А (рис. 1а), равной Т=273,15 К, энтропию S для всех давления можно приближенно принять равной нулю. В Ts-диаграмме (рис. 1а) изобара нагрева воды, парообразования и перегрева пара соответствует кривой АА1В1Д1. Выделим характерные участки. На участке АА1 происходит нагрев воды при постоянном давлении. В точке А1 вода кипит, имея температуру насыщения (кипения) Т при данном давлении. В области влажного пара (участок А1В1) температура постоянна и равна температуре насыщения, изобара расположена параллельно оси энтропии S. В точке В1 – сухой насыщенный пар при данном давлении. На участке В1Д1 – перегретый пар. Температура перегретого пара Т больше температуры насыщения Т при данном давлении.
Представим целую систему изобар (Р2>Р1; Р3>Р2) в диаграмме (рис. 1б). Соединим точки А1; А1’; А1’’ кипения воды при соответствующих давлениях Р1, Р2, Р3 и получим левую пограничную кривую АК. Соединив точки В1, В1’, В1’’сухого насыщенного пара при давлении Р1, Р2, Р3 – правую пограничную кривую КВ. Параметры критической точки К для воды – давление Ркр=22,1 Мпа, температура Ткр=647,3 К. в критической точке отсутствует граница раздела – мениск между жидкой и газообразной фазой.