
- •5)Работа расширения и техническая работа
- •6)Первый закон термодинамики
- •Частные случаи первого закона термодинамики для изопроцессов
- •7 ) Второе начало термодинамики .Обратимые и необратимые процессы .Энропия .
- •Обратимые и необратимые процессы
- •Смесь газов. Закон Дальтона.
- •12. Адиабатный процесс
- •13 .Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
- •14. Самым простым и известным уравнением состояния является уравнение состояния идеального газа:
- •15)Термодинамические свойства паров и жидкостей. Фазовые переходы. Расчет параметров влажного пара.
- •16)Термодинамические процессы реальных газов и паров
- •17)Адиабатный процесс расширения и сжатия реальных газов и паров.
- •18)Влажный воздух. Основные понятия и определения. H-d- диаграмма влажного воздуха.
- •19)Общие уравнения истечения газов и паров. Уравнение сплошности. Сопло и диффузор.
- •20)Истечение идеального газа. Максимальных расход. Сопло Лаваля.
14. Самым простым и известным уравнением состояния является уравнение состояния идеального газа:
pV = nRT
где R – универсальная газовая постоянная.
Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурах, особенно когда газ близок к конденсации.
Так, для газов с низкой температурой сжижения (He, H2, Ne и даже N2, O2, Ar, CO, CH4) при давлениях до 50 атм отклонения не превышают 5%, а при давлениях до 10 атм – 2%. Легко конденсирующиеся газы (CO2, SO2, Cl2, CH3Cl) уже при 1 атм обнаруживают отклонения до 2 – 3%.
Ван-дер-Ваальс в 1873 г. дал функциональную интерпретацию внутреннего давления. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса) обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса:
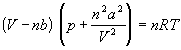 или
для одного моля
или
для одного моля
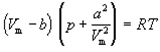
15)Термодинамические свойства паров и жидкостей. Фазовые переходы. Расчет параметров влажного пара.
Термодинамические свойства пара и газа различны, поэтому свойства парогазовой смеси зависят от ее количественного состава. Если же в смеси содержится значительное количество пара в состоянии, близком к сжижению, то применение к такой смеси законов идеальных газов приводит к определенной погрешности и тем большей, чем больше содержится пара в парогазовой смеси.
Термодинамические свойства пара и газа различны, поэтому свойства парогазовой смеси зависят от ее количественного состава. При небольших содержаниях пара или небольших давлениях ненасыщенный газ обладает свойствами, близкими к свойствам идеального газа, законы которого могут быть применены в этом случае с достаточно высокой степенью точности. Если же в смеси содержится значительное количество пара в состоянии, близком к сжижению, то применение к такой смеси законов идеальных газов приводит к определенной погрешности и тем большей, чем больше содержится пара в парогазовой смеси.
Исследуются термодинамические свойства паров, жидкостей, твердых тел. Появляются десятки уравнений состояния вещества, изучаются фазовые равновесия и фазовые превращения, ведется исследование электрических и магнитных процессов лучистой энергии, химических реакций, термодинамики реальных тел.
Для жидкостей - состояние реальной жидкости при стандартном давлении; иногда приводяттермодинамические свойства гипотетического пара этой жидкости в состоянии идеального газа и при стандартном давлении.
Влажность пара — отношение содержащейся в насыщенном паре капельной жидкости к общему количеству смеси фаз
Y=Gf/Gf+Gs где — масса жидкой фазы, — масса сухого пара. Аналогично определяетсясухость пара
X=Gs/Gf+Gs=1-y Обе величины могут, очевидно, принимать значения от 0 до 1. В расширенном понимании сухость пара, или паросодержание жидкостно-паровой смеси, можно определить через энтальпию среды и энтальпии насыщенной жидкости и сухого насыщенного пара как
X=i-i`/i``-i` Данная величина может быть отрицательной для недогретой до кипения воды и превосходить единицу для перегретого пара.
