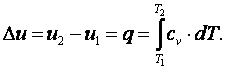- •5)Работа расширения и техническая работа
- •6)Первый закон термодинамики
- •Частные случаи первого закона термодинамики для изопроцессов
- •7 ) Второе начало термодинамики .Обратимые и необратимые процессы .Энропия .
- •Обратимые и необратимые процессы
- •Смесь газов. Закон Дальтона.
- •12. Адиабатный процесс
- •13 .Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
- •14. Самым простым и известным уравнением состояния является уравнение состояния идеального газа:
- •15)Термодинамические свойства паров и жидкостей. Фазовые переходы. Расчет параметров влажного пара.
- •16)Термодинамические процессы реальных газов и паров
- •17)Адиабатный процесс расширения и сжатия реальных газов и паров.
- •18)Влажный воздух. Основные понятия и определения. H-d- диаграмма влажного воздуха.
- •19)Общие уравнения истечения газов и паров. Уравнение сплошности. Сопло и диффузор.
- •20)Истечение идеального газа. Максимальных расход. Сопло Лаваля.
Смесь газов. Закон Дальтона.
Остановимся еще вкратце на смеси идеальных газов.
Смесью газов называется совокупность нескольких разнородных газов, которые при рассматриваемых условиях не вступают друг с другом в химические реакции.
Смесь газов – гомогенная термодинамическая система (внутри которой нет поверхностей раздела, отделяющих друг от друга макроскопические части системы, различающиеся по своим свойствам и составу).
Парциальным давлением Pi i-го газа в смеси называется давление, под которым находился бы этот газ, если бы из смеси были удалены все остальные газы, а V и T остались прежними.
Закон Дальтона: в случае идеальных газов сумма парциальных давлений равна давлению всей газовой смеси: P = P1 + P2 +…+ Pn
(8)
аналогично и для парциальных объемов:
– закон Амага (9)
При расчете параметров состояния смеси идеальных газов можно пользоваться уравнением Менделеева-Клапейрона в форме:
, (10)
где М – масса всей системы;
– кажущийся молекулярный вес.
Для реальных газов наблюдаются отступления, которые будут разобраны на более поздних лекциях.
9. Изохорный процесс (v=const)
Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис. 4.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условие dv=0 или v=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа (см. &1.6) при v=const. В pv-координатах график процесса представляет собой прямую линию, параллельную оси p. Изохорный процесс может протекать с повышением давления (процесс 1-2) и с понижением (процесс 1-2’).
|
Рис. 4.1. График изохорного процесса в p-v координатах |
 апишем
для точек 1 и 2 уравнения состояния:p1·v=R·T1;
p2·v=R·T2.
Следовательно, для изохорного процесса
апишем
для точек 1 и 2 уравнения состояния:p1·v=R·T1;
p2·v=R·T2.
Следовательно, для изохорного процесса
|
(4.6) |
Приращение внутренней энергии газа
|
(4.7) |
Работа газа
|
|
так как dv=0.
Энтальпия газа iv=u+p·v, а div=du+d(p·v)=du+p·dv+v·dp=du+v·dp. Поэтому
|
(4.8) |
Энтропия 
То есть
|
(4.9) |
10. Изобарный процесс (p=const)
В p-v координатах график процесса представляет собой прямую линию параллельную оси v (рис. 4.2). Изобарный процесс может протекать с увеличением объёма (процесс 1-2) и с уменьшением (процесс 1-2’). Запишем для точек 1 и 2 уравнения состояния:p·v1=R·T1; p·v2=R·T2.
|
Рис. 4.2. График изобарного процессав p-v координатах |
 ледовательно,
для изобарного процесса
ледовательно,
для изобарного процесса
|
(4.10) |
Приращение
внутренней энергии газа  Работа
газа
Работа
газа  Так
как p·v2=R·T2,
аp·v1=R·T1,
то l=R·(T2-T1).
Следовательно, газовая постоянная имеет
определённый физический смысл: это
работа 1 кг газа в изобарном процессе
при изменении температуры на один
градус. Из выражения (4.3) следует, что в
изобарном процессе q=cp·(T2-T1).
В соответствии с первым законом
термодинамики для изобарного процесса
можно записать dq=du+p·dv=
du+d(p·v)=di.
Поэтому в изобарном процессеdi=q=cp·(T2-T1).
Из соотношений, характеризующих изобарный
процесс, вытекает известное уравнение
Майера. Так как dq=cp·dT=cv·dT+dl=cv·dT+R·dT,
тоR=cp-cv.
Так
как p·v2=R·T2,
аp·v1=R·T1,
то l=R·(T2-T1).
Следовательно, газовая постоянная имеет
определённый физический смысл: это
работа 1 кг газа в изобарном процессе
при изменении температуры на один
градус. Из выражения (4.3) следует, что в
изобарном процессе q=cp·(T2-T1).
В соответствии с первым законом
термодинамики для изобарного процесса
можно записать dq=du+p·dv=
du+d(p·v)=di.
Поэтому в изобарном процессеdi=q=cp·(T2-T1).
Из соотношений, характеризующих изобарный
процесс, вытекает известное уравнение
Майера. Так как dq=cp·dT=cv·dT+dl=cv·dT+R·dT,
тоR=cp-cv.
Используя выражение (4.5), можно показать, что в изобарном процессе энтропия газа
|
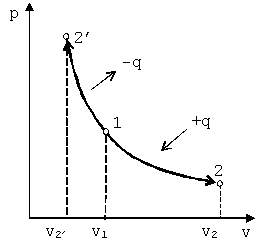
11. Изотермический процесс (T=const)
В p-v координатах график процесса изображается равнобокой гиперболой (рис. 4.3). Изотермический процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).
|
Рис. 4.3. График изотермического процесса вp-v координатах |
 апишем
для точек 1 и 2 уравнения состоянияp1·v1=R·T;
p2·v2=R·T.
Следовательно, для изотермического
процесса p1·v1=p2·v2=const.
апишем
для точек 1 и 2 уравнения состоянияp1·v1=R·T;
p2·v2=R·T.
Следовательно, для изотермического
процесса p1·v1=p2·v2=const.
Приращение внутренней энергии газа
|
|
Работа газа
|
(4.12) |
Теплота, подводимая в процессе
|
(4.13) |
Изменение энтальпии газа Δi=Δu+Δ(p·v)=0.
Изменение энтропии газа
|