
- •1. Механическое движение. Виды механического движения. Материальная точка. Система отсчета. Путь. Перемещение.
- •2. Средняя и мгновенная скорость.
- •3. Ускорение. Разложение вектора ускорения на составляющие.
- •4. Равномерное и равнопеременное движения.
- •5. Кинематические характеристики вращательного движения.
- •6. Инерциальные системы отсчета. Законы Ньютона.
- •7. Виды сил в механике.
- •8. Импульс. Закон сохранения импульса.
- •9. Момент силы. Уравнение моментов.
- •10. Момент импульса
- •11. Закон сохранения момента импульса
- •12. Основной закон динамики вращательного движения.
- •13. Кинетическая энергия вращательного движения.
- •14. Момент инерции. Расчет моментов инерции твердых тел
- •15. Теорема Штейнера.
- •16. Полная механическая энергия. Закон сохранения и изменения полной механической энергии.
- •17. Работа постоянной и переменной силы
- •18. Кинетическая и потенциальная энергии
- •19. Потенциальная энергия гравитационного взаимодействия. Потенциальная
- •20. Удар. Упругий и неупругий удары.
- •21. Колебания. Классификация колебаний.
- •22. Дифференциальное уравнение свободных незатухающих колебаний и его решение.
- •24. Вынужденные колебания. Резонанс.
- •25. Сложение гармонических колебаний.
- •26. Волновые процессы. Параметры, описывающие волновые процессы. Уравнение бегущей волны.
- •27. Основные положения и законы мкт
- •28. Распределение Максвелла. Распределение Больцмана.
- •29. Явления переноса.
- •30. Работа в термодинамике. Внутренняя энергия. Первое начало термодинамики и его применение к изопроцессам.
- •31. Круговой процесс (цикл). Цикл Карно. Второе начало термодинамики.
- •32. Энтропия.
28. Распределение Максвелла. Распределение Больцмана.
f(v) – ф.распределения молекул по скоростям
определяет относительное число атомов или молекул dN(v)/N со скоростями от v до v+dv
f(v) = dN(v)/N = 4П(m0/2ПkT)3/2 v2exp(-m0v2/2kT)
f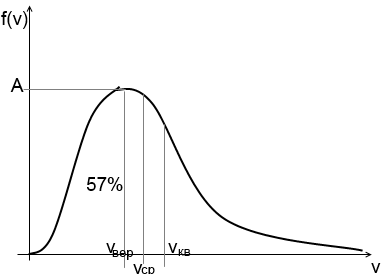 (v)
= Ae-m0v2/2kTv2
(v)
= Ae-m0v2/2kTv2
Выводы:
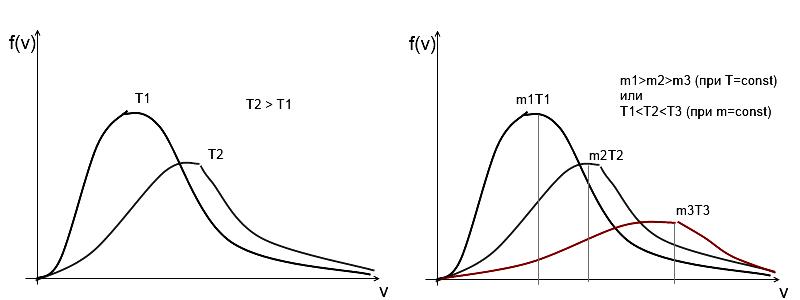
-Вид ф.распределения для каждого газа зависит от рода газа (m0) и от параметра состояния температуры.
Давление и объём на распределение молекул не влияют.
-В показатели степени (у эксп) стоит отношение кин. энергии к средней энергии теплового движения молекул при данной температуре.
-При повышении температуры максимум кривой смещается вправо, общая площадь под кривой не изменяется (величина const=1)

Распределение Больцмана.
n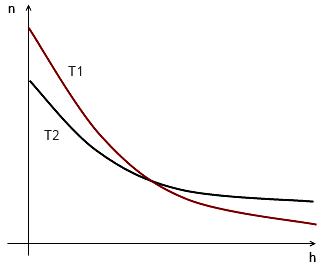 = n0exp(-m0gh/kT)
= n0exp(-m0gh/kT)
где n0 и n – число молекул в ед. объёме при h=0
При Т=0 тепловое движение прекращается, и все молекулы расположились бы на земной поверхности.
При высоких температурах молекулы оказываются распределёнными по высоте почти равномерно, а плотность молекул медленно убывает с высотой.
29. Явления переноса.
Нарушение равновесия приводит к переносу из одних мест среды в другие либо вещества, либо энергии, либо импульса и тд.
Интенсивность процесса переноса х-ся потоком соотв. величины.
Поток к-либо величины – количество этой величины, проходящее в единицу времени через некоторую воображаемую поверхность.
Поток – ск. алгебраическая величина, знак которой определяется выбором направления, вдоль которого поток считается положительным. В случае замкнутых поверхностей принято поток, вытекающий наружу, считать положительным.
Диффузия – обусловленное тепловым движением выравнивание концентраций в смеси нескольких в-в. Этот процесс наблюдается в гжт средах.
Вследствие теплового движения возникает поток молекул каждой из компонент в направлении убывания её концентрации: Ni=-D dni/dz S, где D – коэф диффузии.
Mi=-D dpi/dz S – поток массы (кг/с)
Теплопроводность. Если в некоторой среде создать вдоль оси z градиент температуры, то возникает тепловой поток: q=-χ dT/dz S, где χ – коэф пропорциональности, зависящий от св-в среды и называемый теплопроводностью (Вт/мК)
Внутренне трение.
F = η |du/dz| S, где η – коэф пропорциональности, называемый вязкостью.
Согласно IIзН сила равна производной импульса по времени. Поэтому: K=-η du/dz S, где К – импульс передаваемый от слоя к слою, т.е. поток импульс через поверхность (кг/мс=Па с)
30. Работа в термодинамике. Внутренняя энергия. Первое начало термодинамики и его применение к изопроцессам.
Внутр. энергия – энергия составных частей системы.
Она складывается из теплового хаотического движения молекул, составляющих тело, потенциальной энергией их взаимодействия, а также кин. и потенц. Энергии электронов в атомах, нуклонов в ядрах и тд.
В термодинамике под внутр. энергией понимают энергию теплового хаот. движения молекул.
Внутр. энергия U одного моля ид.газа равна: U=3/2RT
U=i/2RT – для неид.газа
ΔU=i/2νRΔT
В термодинамике важно знать не саму внутр.эн, а её изменение ΔU.
При нагревании внутр.эн. ид.газа возрастает: T↗ ΔU>0 U↗
При охлаждении: T↘ ΔU<0 U↘
Внутр.эн. системы м/б изменена 2 принципиально различными способами: 1) совершением работы; 2) путём теплообмена.
Теплообмен(-передача) – передача энергии от одного тела другому, осуществляемая без совершения работы.
Энергия, переданная телу при теплообмене, называется кол-вом теплоты Q.
Работа и термодинамика.
При изобарном процессе работа газа A=PΔV
Если процесс не изобарный, то можно определить элементарную работу: δA=PdV
![]()
Г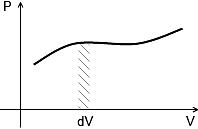 раф.
смысл – площадь трапеции.
раф.
смысл – площадь трапеции.
При расширении газа (dV>0) работа положительна (A>0), т.е. газ совершает работу; при сжатии (dV<0) работа отрицательна (A<0), т.е. работа совершается над газом.
Первое начало термодинамики (закон сохранения энергии применительно к тепловым процессам)
Кол-во теплоты, сообщаемой телу, идёт на увеличение внутр.эн. и на совершение телом работы: Q=ΔU+A, δQ=dU+δA
Применение к изопроцессам.
-Изохорный (V=const)
A=0, Q= ΔU
В изох. процессе все тепло, сообщённое газу, идёт на увеличение его внутр.эн.
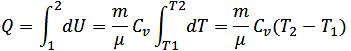
-Изобарный (P=const)
Q=A+ ΔU, δQ=m/μ CpdT = m/μ CVdT+ m/μ RdT
-Изотермический (T=const)
ΔU=0, Q=A
В изотерм. процессе кол-во теплоты, сообщаемое газу, расходуется им на совершение работы против внешних сил.
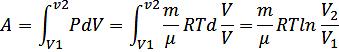
A= m/μ RTln P1/P2
-Адиабатический – процесс, при котором отсутствует теплообмен между термодинам. системой и окр. средой (Q=0)
PVγ=const
TVγ-1=const
TγP1-γ=const
A=- ΔU – газ совершает работу за счёт убыли внутр.эн.
ΔU=-А – в адиаб. расширении газ охлаждается, а при сжатии – нагревается.
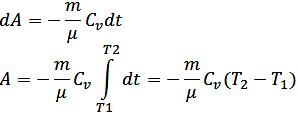
При V=const C=CV
При P=const C=Cp
При T=const C⇒∞
При dQ=0 C=0
