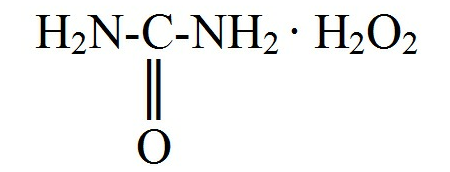Препараты пероксида водорода

Описание. Бесцветная прозрачная жидкость, без запаха, кислой реакции.
MgO2 . MgO
|
Магния перекись Magnesii peroxydum |
Описание. Растворимость. Белый мелкий порошок, без запаха, почти не растворим в воде и спирте. Содержит 25 % перекиси магния. При растворении в минеральных кислотах выделяется H2O2.
|
Гидроперит Hydroperitum |
Описание. Растворимость. Твердое вещество белого цвета, растворимое в воде. Содержит 33-35 % H2O2 и мочевину. Гидроперит легко разлагается при растворении в воде с образованием H2O2.
Качественный анализ
Водорода пероксид^
1. Кислотно-основные свойства:
H2O2 представляет собой очень слабую кислоту: H2O2 ↔ H+ + HO2-
Соли H2O2 неустойчивы: MgO2 + 2 HCl → MgCl2 + H2O2
2. Окислительно-восстановительные свойства:
H2O2
является одновременно и окислителем
и восстановителем:
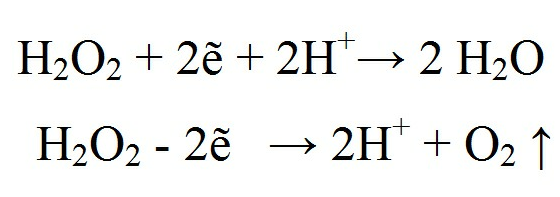
Окисление в кислых растворах протекает медленнее, чем в щелочных.
Окислительные свойства:
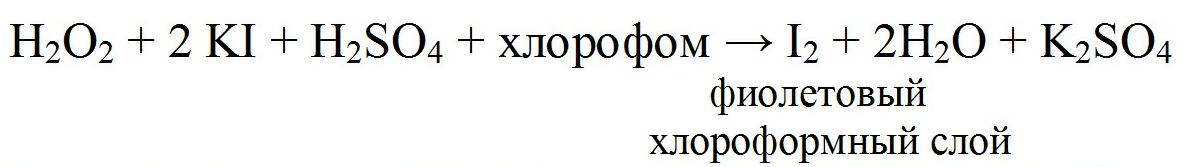
Восстановительные свойства:
![]()
Так как пероксид водорода и окислитель, и восстановитель, то он легко вступает в реакции самоокисления-самовосстановления, при этом разлагается с выделением кислорода:
H2O2 + H2O2 → 2 H2O + O2↑
Пероксид водорода быстро разлагается в щелочной среде, поэтому щелочность стекла, температура, свет и катализаторы (ионы тяжелых металлов) являются причинами изменения концентрации растворов.
3. Реакция образования надхромовых кислот зависит от температуры, pH и концентрации пероксида водорода:
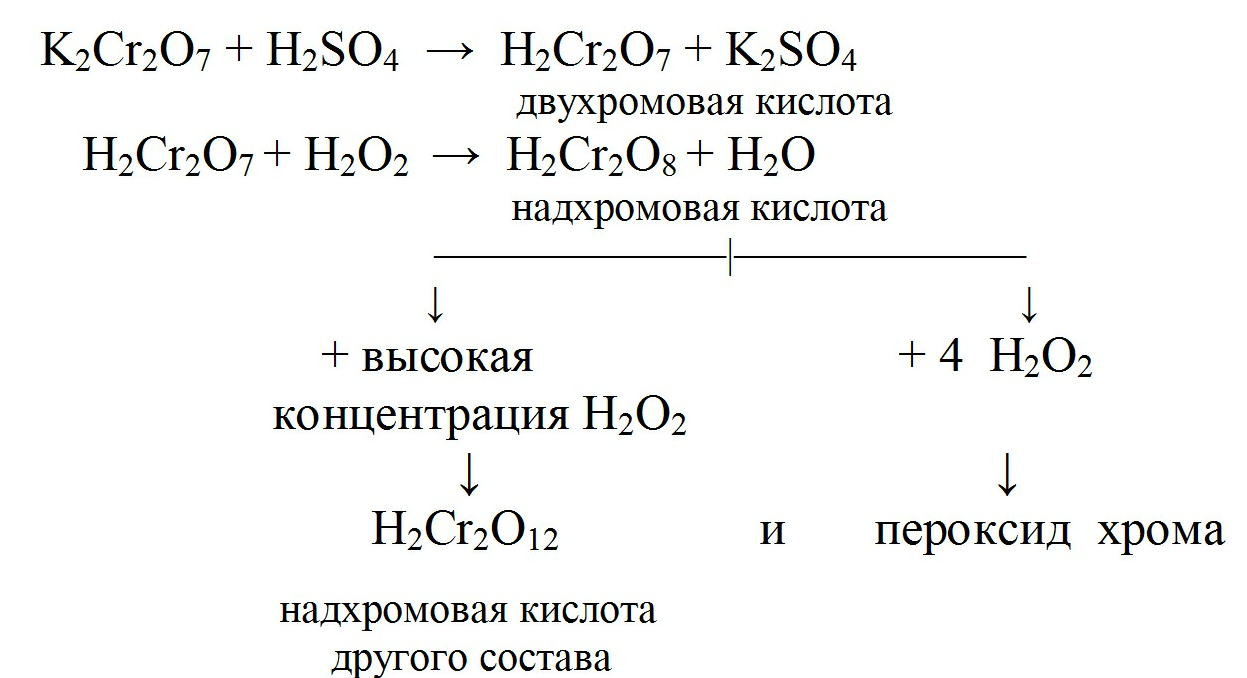
Образуются окрашенные в синий цвет перекисные соединения, растворимые в эфире. Это смесь надхромовых кислот и пероксида хрома.
7. Подлинность магния пероксида доказывают реакциями на ион магния и на пероксид водорода: MgO2 + HCl → MgCl2 + H2O2
MgCl2 + NaHPO4 + NH4OH + NH4Cl → NH4MgPO4 ↓ + 2NaCl
белый
Качество пергидроля определяют по мочевине и также по пероксиду водорода:
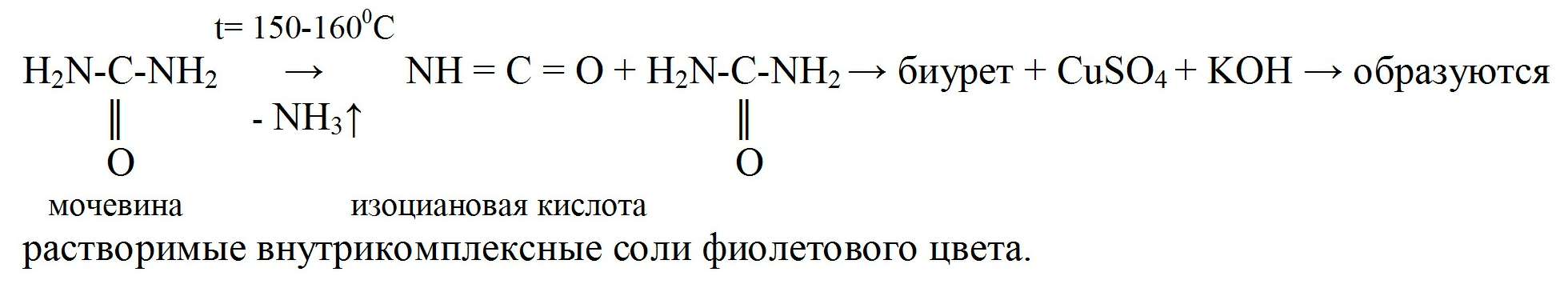
Количественное определение
H2O2: 1) Перманганатометрия. Метод основан на восстанавливающих свойствах водорода пероксида.
5Н2О2+2КМnO4+3H2SO4=5O2+K2SO4+2MnSO4+8H2O
2) Йодометрия основана на окислительных свойствах водорода пероксида.
Н2О2+2KI+H2SO4=I2+ K2SO4+2H2O
I2+2Na2S2O3=2NaI+Na2S4O6
MgO2: MgO2·MgO + H2SO4 → MgSO4 + H2O2 , далее определяют водорода пероксид. Должно быть не более 25 % магния пероксида.
Гидроперит (tb): определяют содержание водорода пероксида йодометрическим методом, а стабилизатора натрия бензоата – ацидиметрией.
Хранение
Хранят в склянках с притертой стеклянной пробкой, в прохладном, защищенном от света месте (3 % раствор), твердые вещества в сухом месте в хорошо укупоренной таре, при комнатной температуре.
При неправильном хранении водорода пероксида может быть взрыв:
2 H2O2 + ок-ли +в.ва + т.м. + следы щелочей → 2 H2O + O2↑ + 188,55 кДж
Ингибиторами этой реакции являются фосфорная, щавелевая, барбитуровая кислоты, мочевина, ацетанилид и др.
При наличии влаги гидроперит образует водорода перекись, а магния пероксид – кристаллогидраты MgO2 ∙ H2O или MgO2∙ 2H2O.
Применение
Применяют как антисептики – 3 % раствор пероксида водорода для промываний, полосканий. Одна таблетка гидроперита 1,5 г соответствует 15 мл 3 %-ного раствора пероксида водорода. Магния пероксид применяют как антисептик ЖКТ по 0,25-0,5 г.