
- •Актуалізація теми
- •Мета і завдання
- •Практичне значення одержаних результатів
- •Теоретична частина розділ 1 анестетики
- •Загальні відомості про анестетики.
- •1. Інгаляційні анестетики (вводяться через дихальні шляхи):
- •2. Неінгаляційні анестетики (як правило, вводяться внутрішньовенно):
- •1.2. Окремі представники анестетиків, їх добування,ідентифікація та застосування
- •Ароматичні солі діазонію
- •2.2 Ваємодія ненасичених сполук з солями діазонію в присутності різноманітних аніонів
- •2.3. Взаємодія ненасичених сполук з солями арилдіазонію в присутності сульфур(VI) оксиду
- •Розділ 3. Синтез жирно-ароматичного триазену на основі анастезину і його взаємодії з бутадієном в присутності сульфур(VI) оксиду
- •Розділ 4. Охорона праці при виконанні дипломної роботи
- •4.1 Правила роботи в лабораторії
- •4.2. Охорона праці при роботі з персональним комп’ютером
- •Фізичні:
- •Психофізіологічні:
- •Експериментальна частина Хлорид n-етилкарбоксифенілдіазонію
- •Ангідрид 1-(n-етилкарбоксифенілсульфоніл)-1,4,5,6-тетрагідрофталевої кислоти
- •Висновки
- •Список використаних джерел
- •Додаток
2.3. Взаємодія ненасичених сполук з солями арилдіазонію в присутності сульфур(VI) оксиду
В 1978 році в Черкаському державному університеті встановлено , що ненасичені сполуки, в яких є подвійні зв’язки з високою електронною густиною, легко вступають в реакцію з хлоридами арилдіазонію в присутності SO2 і приєднують по місцю подвійного зв'язку арилсульфонільні групи і атом Хлору. Так, стирену у водно-ацетоновому розчині насиченому SO2 реагує з хлоридами арилдіазонію і утворює 1-хлор-1-феніл-2-(арилсульфоніл)етани:

Такого типу реакції приєднання було запропоновано називати хлорарилсульфонуванням ненасичених сполук.
В реакцію хлорарилсульфонування дуже активно вступають, крім стирену, ще і спряжені дієни: бутадієн, ізопрен, 2,3-диметилбутадієн-1,3. В процесі реакції арилсульфонільні групи приєднуються в положення 1, а атом Хлору – в положення 4:



Утворення арилсульфонільних радикалів в процесі даних реакцій проходить, напевне, в результаті взаємодії ароматичних арилів, які утворюються із солей арилдіазонію, з атомом Сульфуру його оксиду, який має незайняту пару електронів:
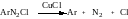

Арилсульфонільні радикали в подальшому реагують з ненасиченими сполуками.
Встановлено, що стирол, бутадієн, ізопрен у оцтово-ацетоновому розчині насиченому SO2 реагують також із сульфатами арилдіазонію, якщо в реакційній суміші присутні тіоцианіідні аніони або бромідні, ксантатні, діетилдитіофосфатні аніони і каталітичні кількості сполук Купрум(І). В таких умовах до ненасичених сполук приєднуються арилсульфонільні радикали і аніони роданідний, бромідний, ксантатний:



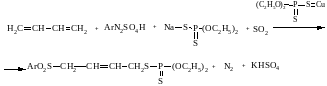
В даних реакціях проходить приєднання роданогрупи і арилсульфонільних радикалів, брому і арилсульфонільних радикалів, ксантатогрупи і арилсульфонільних радикалів,тому такого типу приєднання було названо відповідно реакціями роданоарилсульфону, бромарилсульфонування, ксантатоарилсульфонування .
Механізм реакції хлорарилування:
Більшість дослідників цієї реакції прийшли до висновку, що реакція Меєрвейна, подібно реакції Зандмейєра, каталізується галогенідами міді (І) і проходить за радикальним механізмом.
В реакції Зандмейєра арильні радикали і атоми хлору чи брому зєднуються в відповідні арилгалогеніди. В присутності ж ненасиченої сполуки ці частинки взаємодіють з кратними звязками, утворюючи продукти хлорарилування і арилування.
В умовах реакції Меєрвейна використовується водно-ацетоновий розчин, який містить СиCl2. Хлорид міді (ІІ) відновлюється ацетоном до хлориду міді (І):

Хлорид купруму(І), що утворюється в момент даної реакції, більш активний, ніж СuCl заздалегідь приготовлений.
Розділ 3. Синтез жирно-ароматичного триазену на основі анастезину і його взаємодії з бутадієном в присутності сульфур(VI) оксиду
Ефективне хірургічне знеболювання стало можливим лише після того, як в зв'язку з розвитком хімії вдалося отримати речовини, які мають властивості загальних анестетиків.
В даний час в якості загальних анестетиків використовується велика кількість сполук різноманітної хімічної структури. Фізичні властивості речовин визначають можливі шляхи їхнього введення в організм.
З метою розширення синтетичних можливостей реакції хлорарилсульфонілювання представляло інтерес введення до спряженої системи подвійних зв'язків арилсульфонільних радикалів, з різноманітними замісниками в ароматичному ядрі.
У зв’язку з цим нами було досліджено взаємодію бутадієну з хлоридом n-(етилкарбокси)фенілдіазонію та 1–(n-етилкарбоксифеніл)–3,3-диметил-1-триазеном в присутності купрум(II) хлориду, хлоридної кислоти та сульфур(IV) оксидом.
Встановлено, що бутадієн–1,3 у водно-оцтово-ацетоновому середовищі насиченому сульфур(IV) оксидом в присутності каталітичної кількості купрум(II) хлориду, взаємодіє з діазотованим анестезином. В процесі такої взаємодії виділяється азот діазогрупи, а в положенні 1дієновій системи 1,3-бутадієну приєднується n-етилкарбоксифенілосульфонільні радикали , а в присутності 4 приєднується атом Хлору з утворенням 1–(n-етилкарбоксифенілсульфоніл)-4-хлоро-2-бутену, з виходом продукту 27%:

Продовжуючи дослідження нами було встановленно, що такий продукт хлорарилсульфонілювання можна одержати взаємодією бутадієну з 1-арил-3,3-диметил-1-триазеном одержаним на основі діазотованого анестезину в присутності сульфур(IV) оксиду. Так бутадієн в умовах реакції хлорарилсульфонілювання в присутності хлоридної кислоти взаємодіє з
1-(n-етилкарбоксифеніл)-3,3-диметил-1-триазеном з утворенням
1-(n- етилкарбоксифенілсульфоніл)-4-хлоро-2-бутену, з виходом 32%:

При використанні жирно-ароматичного триазину, одержаного на основі анестезину замість відповідної солі діазонію в реакції хлорарилсульфонілювання спостерігається підвищення виходу цільового продукту на 5%. Одержаний 4-заміщений 1-арилсульфоніл-2-бутен містить в алільному положенні високореакційноздатний атом Хлору. Нами була досліджена реакція елімінування гідроген хлориду 1-(n-етилкарбоксифеніл)-4-хлоро-2-бутену. Встановлено, що при нагріванні даного жирного–ароматичного сульфону з еквімолярною кількість триетиламіну в розчині ацетону, утворюється з виходом 54% з 1-(n-етилкарбоксифенілсульфоніл)-1,3-бутадієн:

Для підтвердження наявності спряженої системи подвійних зв’язків у 1-(n-етилкарбоксифенілсульфоніл)-4-хлоро-2-бутені, нами було досліджено данний дієн у реакції Дільса-Альдера. Встановлено , що при довготривалому сплавленні жирно-ароматичного сульфоніловмісного дієну з свіжосублімованим малеїновим ангідридом, утворюється з виходом 9% ангідрид 1-(n-етилкарбоксифенілсульфоніл)-1,4,5,6-тетрагідрофталевої кислоти:

Незначний вихід адукту свідчить,що n-етилкарбоксифенілсульфонільний зменшує електронну густину спряженої системи подвійних зв’язків дієну. Тому 1-(n-етилкарбоксифенілсульфоніл)-1,3-бутадієн в реакцію Дільса-Альдера вступає надзвичайно важко.
Одержані нами жирно-ароматичні сильфони містять залишок такого анестезуючого засобу як анестезин, і на нашу думку є об’єктами з потенційною фізіологічною активністю, а також можуть бути використані ,як синтони в тонкому органічному синтезі.
