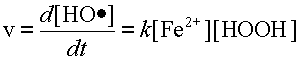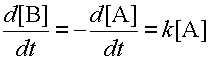- •Кинетика химических реакций Введение
- •Скорость химической реакции
- •От чего зависит скорость реакции
- •Порядок рeакции
- •Кинетика простейших реакций
- •Реакции первого порядка
- •Обратимые реакции
- •Построение линейных анаморфоз
- •Последовательные и параллельные реакции Последовательные реакции с одним промежуточным продуктом
- •Стационарное состояние
- •"Ловушки" нестабильных метаболитов
Кинетика химических реакций Введение
Когда происходит химическая реакция, то одни вещества - субстраты реакции - превращаются в другие - продукты реакции. Соответственно этому, с течением времени после начала процесса концентрация субстратов уменьшается, а концентрация продуктов - возрастает. Зависимость изменения концентрации участников реакции (т.е. субстратов и продуктов) от времени называют кинетикой реакции. Кривые таких зависимостей называют кинетическими кривыми, а математические уравнения, которые описывают кинетические кривые, называют уравнениями кинетики.
Итак, повторим некоторые определения:
Субстраты - вещества, вступающие в реакцию
Продукты - вещества, образующиеся в результате реакции
Промежуточные вещества -продукты, сразу же вступающие в новую реакцию
Скорость реакции - изменение концентрации одного из продуктов, который рассматривается в качестве главного.
Скорость химической реакции
Концентрации веществ в химии принято выражать в киломолях на кубический метр (кмоль/м3) или, что то же самое, в молях на литр (моль/л). Концентрации в таких единицах называют молярными концентрациями и обозначают большой буквой М. Полумолярный раствор (0,5 моль/л) NaCl обозначают как 0,5М NaCl.
Молярная концентрация вещества в химической кинетике обозначается формулой того же вещества, заключенной в квадратные скобки. Так [Fe2+] - это молярная концентрация ионов двухвалентного железа.
Скорость химической реакции - это изменение концентрации какого-либо из участников реакции за секунду. Таким образом в реакции:
Fe2+ + HOOH Fe3+ + OH + HO•
скорость реакции это:
|
От чего зависит скорость реакции
Интуитивно, каждый понимает, что число молекул, которые вступят в реакцию за единицу времени, зависит от ряда обстоятельств:
от концентрации реагирующих молекул, т.е. от концентрации первого субстрата реакции; в нашем случае это концентрация ионов Fe2+.
от вероятности встретить другую молекулу, которая пропорциональна числу молекул в единице объёма, а следовательно пропорциональна молярной концентрации второго субстрата реакции; в нашем случае это величина [HOOH].
от вероятности того, что столкнувшиеся молекулы прореагируют. Обозначим её через р.
Таким образом, скорость реакции в нашем случае будет равна:
|
(1) |
,
где K- коэффициент пропорциональности. Произведение констант K p в свою очередь является некоторой постоянной и называется константой скорости реакции. Обозначим её через k.
|
(2) |
Порядок рeакции
Поскольку скорость реакции взаимодействия двух веществ пропорциональна произведению концентраций этих двух субстратов, такого типа реакции называются реакциями второго порядка.
Если бы для реакции требовалось одновременное участие трёх субстратов, то скорость её должна была бы зависеть от произведения концентраций всех трёх веществ, и мы бы имели реакцию третьего порядка. Этого однако практически не бывает, поскольку в подобных ситуациях сначала обычно реагируют две молекулы. а уж потом в дело вступает третья.
Известны реакции, где имеется всего один субстрат; сюда относятся реакции распада или изомеризации веществ. В этом случае скорость реакции пропорциональна концентрации этого одного субстрата. Такие реакции называются реакциями первого порядка. Скорость реакции первого порядка A B равна:
|
(3) |